Глава 7.
КРОВО- И ЛИМФООБРАЩЕНИЕ
Клетки многоклеточных организмов теряют непосредственный контакт с внешней
средой и находятся в окружающей их жидкой среде— тканевой, или
межклеточной, жидкости и т. д., откуда черпают необходимые вещества и куда
выделяют продукты обмена.
Состав тканевой жидкости постоянно обновляется благодаря тому, что эта
жидкость находится в тесном контакте с непрерывно движущейся кровью. Из
крови в тканевую жидкость проникают кислород и другие необходимые клеткам
вещества; в кровь, оттекающую от тканей, поступают продукты обмена клеток. От
тканей, помимо крови, оттекает лимфа, которая также уносит часть продуктов
обмена.
Кровь движется по кровеносным сосудам благодаря периодическим
сокращениям сердца. Сердце и сосуды составляют систему
кровообращения.
Оттекающая от тканей венозная кровь поступает в правое предсердие, а
оттуда в правый желудочек сердца. При сокращении его кровь нагнетается в
легочную артерию. Протекая через легкие, она отдает СО2 и насыщается
О2. Система легочных сосудов — легочные артерии, капилляры и вены —
образует малый (легочный) круг кровообращения. Обогащенная
кислородом кровь из легких по легочным венам поступает в левое предсердие,
а оттуда в левый желудочек. При сокращении последнего кровь нагнетается в аорту,
артерии, артериолы и капилляры всех органов и тканей, а оттуда по венам
притекает в правое предсердие. Система этих сосудов образует большой круг
кровообращения (рис. 7.1).
7.1. ДЕЯТЕЛЬНОСТЬ СЕРДЦА
7.1.1. Электрические
явления в сердце, проведение возбуждения
Сокращения сердца происходят вследствие периодически возникающих в
сердечной мышце процессов возбуждения. Сердечная мышца (миокард) обладает рядом
свойств, обеспечивающих ее непрерывную ритмическую деятельность, —
автоматией, возбудимостью, проводимостью, сократимостью.
Возбуждение в сердце возникает периодически под влиянием процессов,
протекающих в нем самом. Это явление получило название автоматии.
Способностью к автоматии обладают определенные участки миокарда, состоящие
из специфической (атипической) мышечной ткани, бедной миофибриллами,
богатой саркоплазмой и напоминающей эмбриональную мышечную ткань.
Специфическая мускулатура образует в сердце проводящую систему, состоящую из
синусно-предсердного (синоатриального) узла — водителя ритма сердца,
расположенного в стенке предсердия у устьев полых вен и
предсердно-желудочкового (атриовентрикулярного) узла, расположенного
в нижней трети правого предсердия и межжелудочковой перегородке. От этого
узла берет начало предсердно-желудочковый пучок (пучок Гиса), прободающий
предсердно-желудочковую перегородку и делящийся на правую и левую ножки,
следующие в межжелудочковой перегородке. В области верхушки сердца ножки
предсердно-желудочкового пучка загибаются вверх и переходят в сеть сердечных
проводящих миоцитов (волокна Пуркинье), погруженных в рабочий
(сократительный) миокард желудочков (рис. 7.2).
|
|
|
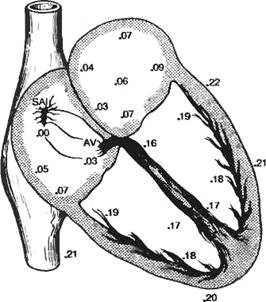
Рис. 7.2. Строение проводящей системы сердца и
хронотопография распространения возбуждения. SA — синоатриальный
узел, AV — атриовентрикулярный узел. Цифры обозначают охват
возбуждением отделов сердца в секундах от момента зарождения импульса
в синоатриалыюм узле.
|
7.1.1.1. Электрическая
активность клеток миокарда
В естественных условиях клетки миокарда находятся в состоянии ритмической
активности (возбуждения), поэтому об их потенциале покоя можно говорить лишь
условно. У большинства клеток он составляет около 90 мВ и определяется почти
целиком концентрационным градиентом ионов К+.
Потенциалы действия (ПД), зарегистрированные в разных отделах сердца при
помощи внутриклеточных микроэлектродов, существенно различаются по форме,
амплитуде и длительности (рис. 7.3, А). На рис. 7.3, Б схематически показан ПД
одиночной клетки миокарда желудочка. Для возникновения этого потенциала
потребовалось деполяризовать мембрану на 30 мВ. В ПД различают следующие фазы:
быструю начальную деполяризацию — фаза 1; медленную реполяризацию, так
называемое плато — фаза 2; быструю реполяризацию — фаза 3; фазу покоя —
фаза 4.
Фаза 1 в клетках миокарда предсердий, сердечных проводящих миоцитов (волокна
Пуркинье) и миокарда желудочков имеет ту же природу, что и восходящая фаза ПД
нервных и скелетных мышечных волокон — она обусловлена повышением натриевой
проницаемости, т. е. активацией быстрых натриевых каналов клеточной мембраны. Во
время пика ПД происходит изменение знака мембранного потенциала (с —90 до
+30 мВ).
|
|
|
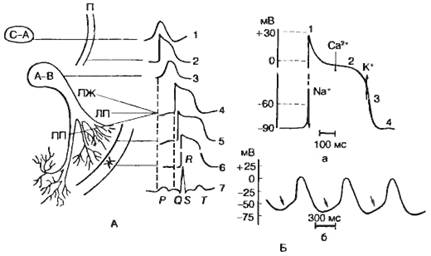
Рис. 7.3. Различные типы потенциалов действия сердечных клеток,
коррелированные с временным ходом ЭКГ.
А — конфигурация потенциалов действия кардиомиоцитов различных отделов
сердца; С—А — синоатриальный узел: П — предсердие; А—В —
предсердно-желудочковый (атриовентрикулярный) узел: ПЖ —
предсердно-желудочковый пучок (пучок Гиса); ПП и ЛП — правая и левая ножки
пучка; Ж — желудочки. 1—6 — потенциалы действия клеток миокарда; 7 — ЭКГ;
Б — потенциал действия одиночной клетки миокарда; а — ПД желудочка.
Стрелками показаны преобладающие потоки ионов Na+,
Са2+, К+, ответственные за различные фазы (1—4) ПД;
б — авторитмическая активность синусно-предсердного (синоатриального)
узла. Стрелками показана медленная диастолическая
деполяризация.
|
Деполяризация мембраны вызывает активацию медленных натрий-кальциевых
каналов. Поток ионов Са2+ внутрь клетки по этим каналам приводит к
развитию плато ПД (фаза 2). В период плато натриевые каналы инактивируются и
клетка переходит в состояние абсолютной рефрактерности. Одновременно происходит
активация калиевых каналов. Выходящий из клетки поток ионов К+
обеспечивает быструю реполяризацию мембраны (фаза 3), во время которой
кальциевые каналы закрываются, что ускоряет процесс реполяризации
(поскольку падает входящий кальциевый ток, деполяризующий мембрану).
Реполяризация мембраны вызывает постепенное закрывание калиевых и
реактивацию натриевых каналов. В результате возбудимость миокардиальной клетки
восстанавливается — это период так называемой относительной рефрактерности.
В клетках рабочего миокарда (предсердия, желудочки) мембранный потенциал
(в интервалах между следующими друг за другом ПД) поддерживается на более или
менее постоянном уровне. Однако в клетках синусно-предсердного узла,
выполняющего роль водителя ритма сердца, наблюдается спонтанная диастолическая
деполяризация (фаза 4), при достижении критического уровня которой
(примерно —50 мВ) возникает новый ПД (см. рис. 7.3, Б). На этом механизме
основана авторитмическая активность указанных сердечных клеток.
Биологическая активность этих клеток имеет и другие важные особенности: 1) малую
крутизну подъема ПД; 2) медленную реполяризацию (фаза 2), плавно переходящую в
фазу быстрой реполяризации (фаза 3), во время которой мембранный потенциал
достигает уровня —60 мВ (вместо —90 мВ в рабочем миокарде), после чего вновь
начинается фаза медленной диастолической деполяризации. Сходные черты имеет
электрическая активность клеток предсердно-желудочкового узла, однако скорость
спонтанной диастолической деполяризации у них значительно ниже, чем у
клеток синусно-предсердного узла, соответственно ритм их потенциальной
автоматической активности меньше.
Ионные механизмы генерации электрических потенциалов в клетках водителя ритма
полностью не расшифрованы. Установлено, что в развитии медленной диастолической
деполяризации и медленной восходящей фазы ПД клеток синусно-предсердного
узла ведущую роль играют кальциевые каналы. Они проницаемы не только для ионов
Са2+, но и для ионов Na+. Быстрые натриевые каналы не
принимают участия в генерации ПД этих клеток.
Скорость развития медленной диастолической деполяризации регулируется
автономной (вегетативной) нервной системой. В случае влияния симпатической части
медиатор норадреналин активирует медленные кальциевые каналы, вследствие чего
скорость диастолической деполяризации увеличивается и ритм спонтанной
активности возрастает. В случае влияния парасимпатической части медиатор АХ
повышает калиевую проницаемость мембраны, что замедляет развитие диастолической
деполяризации или прекращает ее, а также гиперполяризует мембрану. По этой
причине происходит урежение ритма или прекращение автоматии.
Способность клеток миокарда в течение жизни человека находиться в
состоянии непрерывной ритмической активности обеспечивается эффективной
работой ионных насосов этих клеток. В период диастолы из клетки выводятся ионы
Na+, а в клетку возвращаются ионы К+. Ионы
Са2+, проникшие в цитоплазму, поглощаются эндоплазматической сетью.
Ухудшение кровоснабжения миокарда (ишемия) ведет к обеднению запасов АТФ и
креатинфосфата в миокардиальных клетках; работа насосов нарушается, вследствие
чего уменьшается электрическая и механическая активность миокардиальных
клеток.
7.1.1.2. Функции проводящей системы
сердца
Спонтанная генерация ритмических импульсов является результатом
слаженной деятельности многих клеток синусно-предсердного узла, которая
обеспечивается тесными контактами (нексусы) и электротоническим взаимодействием
этих клеток. Возникнув в синусно-предсердном узле, возбуждение распространяется
по проводящей системе на сократительный миокард.
Особенностью проводящей системы сердца является способность каждой клетки
самостоятельно генерировать возбуждение. Существует так называемый градиент
автоматии, выражающийся в убывающей способности к автоматии различных участков
проводящей системы по мере их удаления от синусно-предсердного узла,
генерирующего импульса с частотой до 60—80 в минуту.
В обычных условиях автоматия всех нижерасположенных участков проводящей
системы подавляется более частыми импульсами, поступающими из
синусно-предсердного узла. В случае поражения и выхода из строя этого узла
водителем ритма может стать предсердно-желудочковый узел. Импульсы при этом
будут возникать с частотой 40—50 в минуту. Если окажется выключенным и этот
узел, водителем ритма могут стать волокна предсердно-желудочкового пучка (пучок
Гиса). Частота сердечных сокращений в этом случае не превысит 30—40 в минуту.
Если выйдут из строя и эти водители ритма, то процесс возбуждения спонтанно
может возникнуть в клетках волокон Пуркинье. Ритм сердца при этом будет
очень редким — примерно 20 в минуту.
Отличительной особенностью проводящей системы сердца является наличие в
ее клетках большого количества межклеточных контактов — нексусов. Эти
контакты являются местом перехода возбуждения с одной клетки на другую. Такие же
контакты имеются и между клетками проводящей системы и рабочего миокарда.
Благодаря наличию контактов миокард, состоящий из отдельных клеток,
работает как единой целое. Существование большого количества межклеточных
контактов увеличивает надежность проведения возбуждения в миокарде.
Возникнув в синусно-предсердном узле, возбуждение распространяется по
предсердиям, достигая предсердно-желудочкового (атриовентрикулярного) узла. В
сердце теплокровных животных существуют специальные проводящие пути между
синусно-предсердным и предсердно-желудочковым узлами, а также между правым и
левым предсердиями. Скорость распространения возбуждения в этих проводящих
путях ненамного превосходит скорость распространения возбуждения по рабочему
миокарду. В предсердно-желудочковом узле благодаря небольшой толщине его
мышечных волокон и особому способу их соединения возникает некоторая задержка
проведения возбуждения. Вследствие задержки возбуждение доходит до
предсердно-желудочкового пучка и сердечных проводящих миоцитов (волокна
Пуркинье) лишь после того, как мускулатура предсердий успевает сократиться и
перекачать кровь из предсердий в желудочки.
Следовательно, атриовентрикулярная задержка обеспечивает необходимую
последовательность (координацию) сокращений предсердий и желудочков.
Скорость распространения возбуждения в предсердно-желудочковом пучке и в
диффузно расположенных сердечных проводящих миоцитах достигает 4,5—5 м/с, что в
5 раз больше скорости распространения возбуждения по рабочему миокарду.
Благодаря этому клетки миокарда желудочков вовлекаются в сокращение почти
одновременно, т. е. синхронно (см. рис. 7.2). Синхронность сокращения
клеток повышает мощность миокарда и эффективность нагнетательной функции
желудочков. Если бы возбуждение проводилось не через предсердно-желудочковый
пучок, а по клеткам рабочего миокарда, т. е. диффузно, то период
асинхронного сокращения продолжался бы значительно дольше, клетки миокарда
вовлекались в сокращение не одновременно, а постепенно и желудочки потеряли бы
до 50% своей мощности.
Таким образом, наличие проводящей системы обеспечивает ряд важных
физиологических особенностей сердца: 1) ритмическую генерацию импульсов
(потенциалов действия); 2) необходимую последовательность (координацию)
сокращений предсердий и желудочков; 3) синхронное вовлечение в процесс
сокращения клеток миокарда желудочков (что увеличивает эффективность
систолы).
7.1.1.3. Рефрактерная фаза
миокарда и экстрасистола
Потенциал действия миокарда желудочков длится около 0,3 с (более чем в 100
раз дольше, чем ПД скелетной мышцы). Во время ПД мембрана клетки становится
невосприимчивой к действию других раздражителей, т. е. рефрактерной. Соотношения
между фазами ПД миокарда и величиной его возбудимости показаны на рис. 7.4.
Различают период абсолютны рефрактерности (продолжается 0,27 с, т. е.
несколько короче длительности ПД; период относительны рефрактерности,
во время которого сердечная мышца может ответить сокращением лишь на очень
сильные раздражения (продолжается 0,03 с), и короткий период супернормальной
возбудимости, когда сердечная мышца может отвечать сокращением на
подпороговые раздражения.
|
|
|
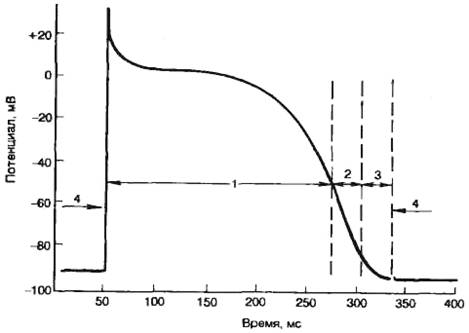
Рис. 7.4. Соотношение изменений возбудимости мышцы сердца и потенциала
действия.
1 — период абсолютной рсфрактерности; 2 — период относительной
рефрактерности; 3 — период супернормальности; 4 — период
полного восстановления нормальной возбудимости.
|
Сокращение (систола) миокарда продолжается около 0,3 с, что по времени
примерно совпадает с рефрактерной фазой. Следовательно, в период сокращения
сердце неспособно реагировать на другие раздражители. Наличие длительной
рефрактерной фазы препятствует развитию непрерывного укорочения (тетануса)
сердечной мышцы, что привело бы к невозможности осуществления сердцем
нагнетательной функции.
Раздражение, нанесенное на миокард в период расслабления (диастолы), когда
его возбудимость частично или полностью восстановлена, вызывает
внеочередное сокращение сердца — экстрасистолу. Наличие или
отсутствие экстрасистол, а также их характер определяется при регистрации
электрокардиограммы.
7.1.1.4. Электрокардиограмма
Охват возбуждением огромного количества клеток рабочего миокарда
вызывает появление отрицательного заряда на поверхности этих клеток. Сердце
становится мощным электрогенератором. Ткани тела, обладая сравнительно высокой
электропроводностью, позволяют регистрировать электрические потенциалы
сердца с поверхности тела. Такая методика исследования электрической
активности сердца, введенная в практику В. Эйнтховеном, А. Ф. Самойловым, Т.
Льюисом, В. Ф. Зелениным и др., получила название электрокардиографии,
а регистрируемая с ее помощью кривая называется электрокардиограммой
(ЭКГ). Электрокардиография широко применяется в медицине как
диагностический метод, позволяющий оценить динамику распространения возбуждения
в сердце и судить о нарушениях сердечной деятельности при изменениях ЭКГ.
В настоящее время пользуются специальными приборами — электрокардиографами с
электронными усилителями и осциллографами. Запись кривых производят на
движущейся бумажной ленте. Разработаны также приборы, при помощи которых
записывают ЭКГ во время активной мышечной деятельности и на расстоянии от
обследуемого. Эти приборы — телеэлектрокардиографы — основаны на принципе
передачи ЭКГ на расстояние с помощью радиосвязи. Таким способом регистрируют ЭКГ
у спортсменов во время соревнований, у космонавтов в космическом полете и
т. д. Созданы приборы для передачи электрических потенциалов, возникающих при
деятельности сердца, по телефонным проводам и записи ЭКГ в специализированном
центре, находящемся на большом расстоянии от пациента.
Вследствие определенного положения сердца в грудной клетке и своеобразной
формы тела человека электрические силовые линии, возникающие между возбужденными
(—) и невозбужденными (+) участками сердца, распределяются по поверхности тела
неравномерно. По этой причине в зависимости от места приложения
электродов форма ЭКГ и вольтаж ее зубцов будут различны. Для регистрации
ЭКГ производят отведение потенциалов от конечностей и поверхности грудной
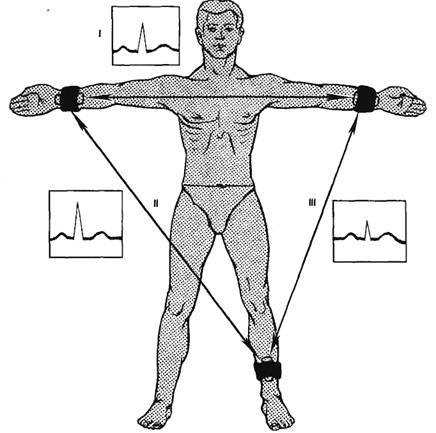
клетки. Обычно используют три так называемых стандартных отведения от
конечностей: I отведение: правая рука — левая рука; II отведение: правая
рука — левая нога; III отведение: левая рука — левая нога (рис. 7.5). Кроме
того, регистрируют три униполярных усиленных отведения по Гольдбергеру:
aVR; aVL; aVF. При регистрации усиленных отведений два электрода,
используемые для регистрации стандартных отведений, объединяются в один и
регистрируется разность потенциалов между объединенными и активными электродами.
Так, при aVR активным является электрод, наложенный на правую руку, при aVL — на
левую руку, при aVF — на левую ногу. Вильсоном предложена регистрация шести
грудных отведений.
|
|
|
Рис. 7.5. Наложение электродов при стандартных отведениях
электрокардиограммы (I—III) и формы ЭКГ, получаемых при этих
отведениях.
|
Взаимоотношение величины зубцов в трех стандартных отведениях было
установлено Эйнтховеном. Он нашел, что электродвижущая сила сердца,
регистрируемая во II стандартном отведении, равна сумме электродвижущих сил в I
и III отведениях. Выражением электродвижущей силы является высота зубцов,
поэтому зубцы II отведения по своей величине равны алгебраической сумме зубцов I
и III отведений.
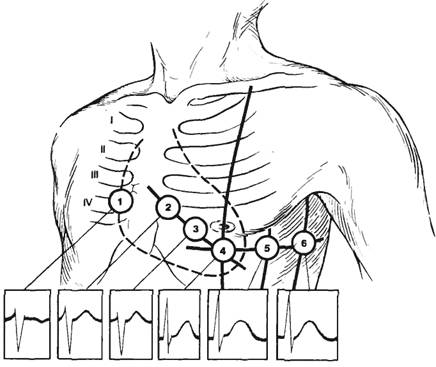
Для отведения потенциалов от грудной клетки рекомендуют прикладывать первый
электрод к одной из шести показанных на рис. 7.6 точек. Вторым электродом служат
три соединенных вместе электрода, наложенных на обе руки и левую ногу. В этом
случае форма ЭКГ отражает электрические изменения только на участке приложения
грудного электрода. Объединенный электрод, приложенный к трем конечностям,
является индифферентным, или «нулевым», так как его потенциал не изменяется
на протяжении всего сердечного цикла. Такие электрокардиографические отведения
называются униполярными, или однополюсными. Эти отведения
обозначаются латинской буквой V (V1, V2 и т. д.).
|
|
|
Рис. 7.6. Места наложения электродов при грудных отведениях
электрокардиограммы (1—6) и формы ЭКГ, получаемых при этих отведениях.
I—IV — межреберные промежутки.
|
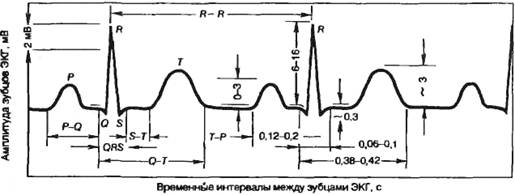
Нормальная ЭКГ человека, полученная во II стандартном отведении,
приведена на рис. 7.7. При анализе ЭКГ определяют амплитуду зубцов в мВ
(mV), время их протекания в с, длительность сегментов — участков
изопотенциальной линии между соседними зубцами и интервалов, включающих в себя
зубец и прилегающий к нему сегмент.
Формирование ЭКГ (ее зубцов и интервалов) обусловлено распространением
возбуждения в сердце и отображает этот процесс. Зубцы возникают и развиваются,
когда между участками возбудимой системы имеется разность потенциалов, т.
е. какая-то часть системы охвачена возбуждением, а другая нет. Изопотенциальная
линия возникает в случае, когда в пределах возбудимой системы нет разности
потенциалов, т. е. вся система не возбуждена или, наоборот, охвачена
возбуждением. С позиций электрокардиологии, сердце состоит из двух возбудимых
систем — двух мышц: мышцы предсердий и мышцы желудочков. Эти две мышцы разделены
соединительнотканной фиброзной перегородкой. Связь между двумя мышцами и
передачу возбуждения осуществляет проводящая система сердца. В силу того,
что мышечная масса проводящей системы мала, генерируемые в ней потенциалы при
обычных усилениях стандартных электрокардиографов не улавливаются.
Следовательно, зарегистрированная ЭКГ отражает последовательный охват
возбуждением сократительного миокарда предсердий и желудочков.
Зубец Р (см. рис. 7.7) отображает охват возбуждением предсердий и
получил название предсердного. Далее возбуждение распространяется на
предсердно-желудочковый узел и движется по проводящей системе желудочков. В это
время электрокардиограф регистрирует изопотенциальную линию (оба предсердия
полностью возбуждены, оба желудочка еще не возбуждены, а движение
возбуждения по проводящей системе желудочков не улавливается
электрокардиографом — сегмент PQ на ЭКГ).
|
|
|
Рис. 7.7. Электрокардиограмма во II стандартном отведении.
|
В предсердиях возбуждение распространяется преимущественно по сократительному
миокарду лавинообразно от синусно-предсердной к предсердно-желудочковой области.
Скорость распространения возбуждения по специализированным внутрипредсердным
пучкам в норме примерно равна скорости распространения по сократительному
миокарду предсердия, поэтому охват возбуждением предсердий отображается
монофазным зубцом Р. Охват возбуждением желудочков осуществляется
посредством передачи возбуждения с элементов проводящей системы на
сократительный миокард, что обусловливает сложный характер комплекса QRS,
отражающего охват возбуждением желудочков. При этом зубец Q
обусловлен возбуждением верхушки сердца, правой сосочковой мышцы и
внутренней поверхности желудочков, зубец R — возбуждением основания
сердца и наружной поверхности желудочков. Процесс полного охвата
возбуждением миокарда желудочков завершается к окончанию формирования
зубца S. Теперь оба желудочка возбуждены и сегмент ST находится на
изопотенциальной линии вследствие отсутствия разности потенциалов в возбудимой
системе желудочков.
Зубец Т отражает процессы реполяризации, т. е. восстановление
нормального мембранного потенциала клеток миокарда. Эти процессы в различных
клетках возникают не строго синхронно. Вследствие этого появляется разность
потенциалов между еще деполяризованными участками миокарда (т. е.
обладающими отрицательным зарядом) и участками миокарда, восстановившими
свой положительный заряд. Указанная разность потенциалов регистрируется в
виде зубца Т. Этот зубец — самая изменчивая часть ЭКГ. Между зубцом Т
и последующим зубцом Р регистрируется изопотенциальная линия, так как
в это время в миокарде желудочков и в миокарде предсердий нет разности
потенциалов. Видимого отображения на ЭКГ зубца, соответствующего
реполяризации предсердий, нет в связи с тем, что он по времени совпадает с
мощным комплексом QRS и поглощается им. При поперечной блокаде сердца,
когда не каждый зубец Р сопровождается комплексом QRS,
наблюдается предсердный зубец Та (T-атриум),
отображающий реполяризацию предсердий.
Общая продолжительность электрической систолы желудочков (Q—T)
почти совпадает с длительностью механической систолы (механическая систола
начинается несколько позже, чем электрическая).
Электрокардиограмма позволяет оценить характер нарушений проведения
возбуждения в сердце. Так, по величине интервала Р—Q (от начала
зубца Р и до начала зубца Q) можно судить о том, совершается ли
проведение возбуждения от предсердия к желудочку с нормальной скоростью. В норме
это время равно 0,12—0,2 с. Общая продолжительность комплекса QRS
отражает скорость охвата возбуждением сократительного миокарда желудочков и
составляет 0,06—0,1 с (см. рис. 7.7).
Процессы деполяризации и реполяризации возникают в разных участках
миокарда неодновременно, поэтому величина разности потенциалов
между различными участками сердечной мышцы на протяжении сердечного цикла
изменяется. Условную линию, соединяющую в каждый момент две точки,
обладающие наибольшей разностью потенциалов, принято называть электрической
осью сердца. В каждый данный момент электрическая ось сердца
характеризуется определенной величиной и направлением, т. е. обладает
свойствами векторной величины. Вследствие неодновременности охвата
возбуждением различных отделов миокарда этот вектор изменяет свое направление.
Оказалась полезной регистрация нетолько величины разности потенциалов
сердечной мышцы (т. е. амплитуды зубцов на ЭКГ), но и изменений направления
электрической оси желудочков сердца. Одновременная запись изменений величины
разности потенциалов и направления электрической оси получило название
векторэлектрокардиограммы (ВЭКГ).
Изменение ритма сердечной деятельности. Электрокардиография позволяет
детально анализировать изменения сердечного ритма. В норме частота сердечных
сокращений составляет 60—80 в минуту, при более редком ритме — брадикардии
— 40—50, а при более частом — тахикардии — превышает 90—100 и доходит
до 150 и более в минуту. Брадикардия часто регистрируется у спортсменов в
состоянии покоя, а тахикардия — при интенсивной мышечной работе и эмоциональном
возбуждении.
У молодых людей наблюдается регулярное изменение ритма сердечной деятельности
в связи с дыханием — дыхательная аритмия. Она состоит в том, что в
конце каждого выдоха частота сердечных сокращений урежается.
Экстрасистолы. При некоторых патологических состояниях сердца правильный
ритм эпизодически или регулярно нарушается внеочередным сокращением —
экстрасистолой. Если внеочередное возбуждение возникает в
синусно-предсердном узле в тот момент, когда рефрактерный период закончился, но
очередной автоматический импульс еще не появился, наступает раннее
сокращение сердца — синусовая экстрасистола. Пауза, следующая за
такой экстрасистолой, длится такое же время, как и обычная.
Внеочередное возбуждение, возникшее в миокарде желудочков, не отражается на
автоматии синусно-предсердного узла. Этот узел своевременно посылает очередной
импульс, который достигает желудочков в тот момент, когда они еще находятся
в рефрактерном состоянии после экстрасистолы, поэтому миокард желудочков не
отвечает на очередной импульс, поступающий из предсердия. Затем рефрактерный
период желудочков кончается и они опять могут ответить на раздражение, но
проходит некоторое время, пока из синусно-предсердного узла придет второй
импульс. Таким образом, экстрасистола, вызванная возбуждением, возникшим в одном
из желудочков (желудочковая экстрасистола), приводит к
продолжительной так называемой компенсаторной паузе желудочков при
неизменном ритме работы предсердий.
У человека экстрасистолы могут появиться при наличии очагов раздражения в
самом миокарде, в области предсердного или желудочковых водителей ритма.
Экстрасистолии могут способствовать влияния, поступающие в сердце из ЦНС.
Трепетание и мерцание сердца. В патологии можно наблюдать своеобразное
состояние мышцы предсердий или желудочков сердца, называемое трепетанием
и мерцанием (фибрилляция). При этом происходят чрезвычайно частые и
асинхронные сокращения мышечных волокон предсердий или желудочков — до 400
(при трепетании) и до 600 (при мерцании) в минуту. Главным отличительным
признаком фибрилляции служит неодновременность сокращений отдельных
мышечных волокон данного отдела сердца. При таком сокращении мышцы предсердий
или желудочков не могут осуществлять нагнетание крови. У человека фибрилляция
желудочков, как правило, смертельна, если немедленно не принять меры для ее
прекращения. Наиболее эффективным способом прекращения фибрилляции
желудочков является воздействие сильным (напряжением в несколько киловольт)
ударом электрического тока, по-видимому, вызывающим одновременно возбуждение
мышечных волокон желудочка, после чего восстанавливается синхронность их
сокращений.
ЭКГ и ВЭКГ отражают изменения величины и направления потенциалов действия
миокарда, но не позволяют оценить особенности нагнетательной функции
сердца. Потенциалы действия мембраны клеток миокарда представляют собой
лишь пусковой механизм сокращения клеток миокарда, включающий определенную
последовательность внутриклеточных процессов, заканчивающихся
укорочением миофибрилл. Эта серия последовательных процессов получила
название сопряжения возбуждения и сокращения.
7.1.2. Нагнетательная функция
сердца
Сердце нагнетает кровь в сосудистую систему благодаря периодическому
синхронному сокращению мышечных клеток, составляющих миокард предсердий и
желудочков. Сокращение миокарда вызывает повышение давления крови и изгнание ее
из камер сердца. Вследствие наличия общих слоев миокарда у обоих предсердии и у
обоих желудочков и одновременного прихода возбуждения к клеткам миокарда по
сердечным проводящим миоцитам (волокнам Пуркинье) сокращение обоих предсердий, а
затем и обоих желудочков осуществляется одновременно.
Сокращение предсердий начинается в области устьев полых вен, вследствие чего
устья сжимаются, поэтому кровь может двигаться только в одном направлении — в
желудочки через предсердно-желудочковые отверстия. В этих отверстиях расположены
клапаны. В момент диастолы предсердий створки клапанов расходятся, клапаны
раскрываются и пропускают кровь из предсердий в желудочки. В левом желудочке
находится левый предсердно-желудочковый (двустворчатый, или митральный)
клапан, в правом — правый предсердно-желудочковый (трехстворчатый). При
сокращении желудочков кровь устремляется в сторону предсердий и захлопывает
створки клапанов. Открыванию створок в сторону предсердий препятствуют
сухожильные нити, при помощи которых края створок прикрепляются к
сосочковым мышцам. Последние представляют собой выросты внутреннего мышечного
слоя стенки желудочков. Являясь частью миокарда желудочков, сосочковые мышцы
сокращаются вместе с ними, натягивая сухожильные нити, которые, подобно вантам
парусов, удерживают створки клапанов.
Повышение давления в желудочках при их сокращении приводит к изгнанию крови:
из правого желудочка в легочную артерию, а из левого желудочка — в аорту. В
устьях аорты и легочной артерии имеются полулунные клапаны — клапан аорты и
клапан легочного ствола соответственно. Каждый из них состоит из трех лепестков,
прикрепленных наподобие клапанных карманов к внутренней поверхности
указанных артериальных сосудов. При систоле желудочков выбрасываемая ими
кровь прижимает эти лепестки к внутренним стенкам сосудов. Во время диастолы
кровь устремляется из аорты и легочной артерии обратно в желудочки и при этом
захлопывает лепестки клапанов. Эти клапаны могут выдерживать большое
давление, они не пропускают кровь из аорты и легочной артерии в
желудочки.
Во время диастолы предсердий и желудочков давление в камерах сердца падает,
вследствие чего кровь начинает притекать из вен в предсердия и далее через
предсердно-желудочковые (атриовентрикулярные) отверстия — в желудочки, в которых
давление снижается до нуля и ниже.
Наполнение сердца кровью. Поступление крови в сердце обусловлено рядом
причин. Первой из них является остаток движущей силы, вызванной предыдущим
сокращением сердца. О наличии этой остаточной силы свидетельствует то, что из
периферического конца нижней полой вены, перерезанной вблизи сердца, течет
кровь, что было бы невозможно в случае, если бы сила предыдущего сердечного
сокращения была полностью израсходована.
Среднее давление крови в венах большого круга кровообращения равно 7 мм
рт.ст. В полостях сердца во время диастолы оно близко к нулю. Градиент давления,
обеспечивающий приток венозной крови к сердцу, около 7 мм рт. ст. Это величина
очень небольшая, и поэтому любые препятствия току венозной крови (например,
легкое случайное сдавливание полых вен во время хирургической операции) могут
полностью прекратить доступ крови к сердцу. Сердце выбрасывает в артерии
лишь ту кровь, которая притекает к нему из вен, поэтому прекращение венозного
притока немедленно приводит к прекращению выброса крови в артериальную систему,
падению артериального давления.
Вторая причина притока крови к сердцу — сокращение скелетных мышц и
наблюдающееся при этом сдавливание вен конечностей и туловища. В венах имеются
клапаны, пропускающие кровь только в одном направлении — к сердцу. Периодическое
сдавливание вен вызывает систематическую подкачку крови к сердцу. Эта так
называемая венозная помпа обеспечивает значительное увеличение
притока венозной крови к сердцу, а значит, и сердечного выброса при физической
работе.
Третья причина поступления крови в сердце — присасывание ее грудной клеткой,
особенно во время вдоха. Грудная клетка представляет собой герметически
закрытую полость, в которой вследствие эластической тяги легких существует
отрицательное давление. В момент вдоха сокращение наружных межреберных мышц
и диафрагмы увеличивает эту полость: органы грудной полости, в частности полые
вены, подвергаются растяжению и давление в полых венах и предсердиях
становится отрицательным. Именно поэтому к ним сильнее притекает кровь с
периферии.
Имеются данные о существовании механизма, непосредственно присасывающего
кровь в сердце. Этот механизм состоит в том, что во время систолы желудочков,
когда укорачивается их продольный размер, предсердно-желудочковая
перегородка оттягивается книзу, что вызывает расширение предсердий и приток
в них крови из полых вен. Предполагают наличие и других механизмов, активно
доставляющих кровь в сердце. Наконец, определенное значение имеет присасывающая
сила расслабляющихся желудочков, которые, подобно отпущенной резиновой
груше, восстанавливая свою форму во время диастолы, создают разрежение в
полостях.
Во время диастолы в желудочки притекает около 70% общего объема крови. При
систоле предсердий в желудочки подкачивается еще около 30% этого объема. Таким
образом, значение нагнетательной функции миокарда предсердий для
кровообращения сравнительно невелико. Предсердия являются резервуаром для
притекающей крови, легко изменяющим свою вместимость благодаря небольшой
толщине стенок. Объем этого резервуара может возрастать за счет наличия
дополнительных емкостей — ушек предсердий, напоминающих кисеты, способные при
расправлении вместить значительные объемы крови.
7.1.2.1. Фазы сердечного цикла
Сокращение сердца сопровождается изменениями давления в его полостях и
артериальных сосудах, возникновением тонов сердца, появлением пульсовых волн и
т. д. При одновременной графической регистрации этих явлений можно определить
длительность фаз сердечного цикла.
Под сердечным циклом понимают период, охватывающий одно сокращение — систола,
и одно расслабление — диастола предсердий и желудочков. Пример синхронной
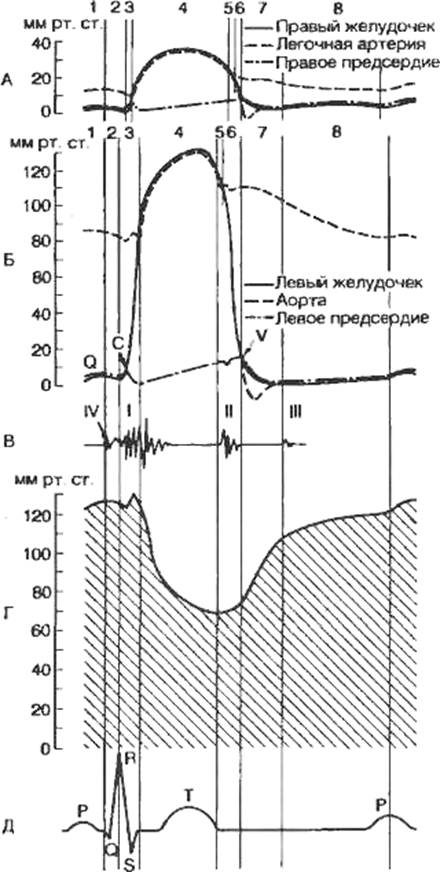
регистрации ряда процессов при деятельности сердца представлен на рис. 7.8.
Кривые записаны при частоте сердечных сокращений 75 в минуту. В этом случае
общая длительность сердечного цикла равна 0,8 с. Сокращение сердца
начинается с систолы предсердий, длящейся 0,1 с. Давление в предсердиях при этом
поднимается до 5—8 мм рт.ст. Систола предсердии сменяется систолой желудочков
продолжительностью 0,33 с. Систола желудочков разделяется на несколько
периодов и фаз.
Период напряжения длится 0,08 с. и состоит из двух фаз.
Фаза асинхронного сокращения миокарда желудочков длится 0,05 с. Точкой
отсчета начала этой фазы служит зубец Q ЭКГ, свидетельствующий о начале
возбуждения желудочков. В течение этой фазы процесс возбуждения и следующий за
ним процесс сокращения распространяются по миокарду желудочков. Давление в
желудочках еще близко к нулю. К концу фазы сокращение охватывает все
волокна миокарда, а давление в желудочках начинает быстро нарастать.
Фаза изометрического сокращения (0,03 с.) начинается с
захлопывания створок предсердно-желудочковых (атриовентрикулярных)
клапанов. При этом возникает I, или систолический, тон сердца. Смещение створок
и крови в сторону предсердий вызывает подъем давления в предсердиях. На кривой
регистрации давления в предсердиях виден небольшой зубец. Давление в
желудочках быстро нарастает: до 70—80 мм рт.ст. в левом и до 15—20 мм рт.ст. в
правом.
|
|
|
Рис. 7.8. Схематизированные кривые изменений давления в
правых (А) и левых (Б) отделах сердца, тонов сердца (В), объема желудочков
(Г) и электрокардиограммы (Д).
I—IV — тоны ФКГ; 1 — фаза сокращений предсердий; 2 — фаза асинхронного
сокращения желудочков; 3 — фаза изометрического сокращения
желудочное; 4 — фаза изгнания; 5 — протодиастолический период; 6 — фаза
изометрического расслабленна
желудочков; 7 — фаза быстрого наполнения желудочков; 8 —
фаза медленного наполнения желудочков.
|
Створчатые и полулунные клапаны («вход» и «выход» из желудочков) еще
закрыты, объем крови в желудочках остается постоянным. Вследствие того, что
жидкость практически несжимаема, длина волокон' миокарда не изменяется,
увеличивается только их напряжение. Стремительно растет давление крови в
желудочках. Левый желудочек быстро приобраетает круглую форму и с силой
ударяется о внутреннюю поверхность грудной стенки. В пятом межреберье на 1 см
слева от среднеключичной линии в этот момент определяется верхушечный
толчок.
К концу периода напряжения быстро нарастающее давление в левом и правом
желудочках становится выше давления в аорте и легочной артерии. Кровь из
желудочков устремляется в эти сосуды.
Период изгнания крови из желудочков длится 0,25 с и состоит из фазы
быстрого (0,12 с) и фазы медленного изгнания (0,13 с). Давление в
желудочках при этом нарастает: в левом до 120—130 мм рт.ст., а в правом до 25 мм
рт.ст. В конце фазы медленного изгнания миокард желудочков начинает
расслабляться, наступает его диастола (0,47 с). Давление в желудочках падает,
кровь из аорты и легочной артерии устремляется обратно в полости желудочков и
захлопывает полулунные клапаны, при этом возникает II, или диастолический, тон
сердца.
Время от начала расслабления желудочков до захлопывания полулунных клапанов
называется протодиастолическим периодом (0,04 с). После захлопывания
полулунных клапанов давление в желудочках падает. Створчатые клапаны в это
время еще закрыты, объем крови, оставшейся в желудочках, а следовательно, и
длина волокон миокарда не изменяются, поэтому данный период назван периодом
изометрического расслабления (0,08 с). К концу его давление в желудочках
становится ниже, чем в предсердиях, открываются предсердно-желудочковые
клапаны и кровь из предсердий поступает в желудочки. Начинается период
наполнения желудочков кровью, который длится 0,25 с. и делится на фазы
быстрого (0,08 с) и медленного (0,17 с) наполнения.
Колебания стенок желудочков вследствие быстрого притока крови к ним вызывают
появление III тона сердца. К концу фазы медленного наполнения возникает систола
предсердий. Предсердия нагнетают в желудочки дополнительное количество крови
(пресистолический период, равный 0,1 с), после чего начинается новый цикл
деятельности желудочков.
Колебание стенок сердца, вызванное сокращением предсердий и дополнительным
поступлением крови в желудочки, ведет к появлению IV тона сердца.
При обычном прослушивании сердца хорошо слышны громкие I и II тоны, а тихие
III и IV тоны выявляются лишь при графической регистрации тонов сердца.
Последовательность отдельных фаз цикла деятельности желудочков может
быть представлена следующим образом:
|

|
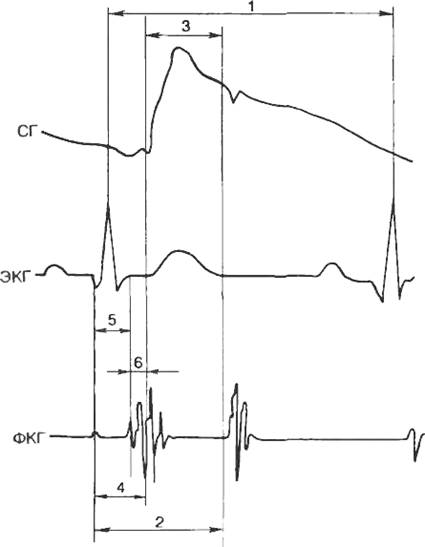
Для фазового анализа цикла сердечной деятельности у человека катетеризацию
сердца обычно не проводят, а используют ряд неинвазивных методов. В частности,
получил распространение метод поликардиографии, основанный на синхронной
регистрации ЭКГ, фонокардиограммы (ФКГ) и сфигмограммы (СП сонной артерии (рис.
7.9). На синхронной записи этих кривых по интервалу R—R ЭКГ
определяют продолжительность цикла (1), по интервалу от начала зубца Q на
ЭКГ до начала II тона на ФКГ определяют продолжительность систолы (2), по
интервалу от начала анакроты до инцизуры на СГ определяют продолжительность
периода изгнания (3), по разности между продолжительностью систолы и периода
изгнания — период напряжения (4), по интервалу между началом зубца Q ЭКГ
и началом I тона ФКГ — период асинхронного сокращения (5), по разнице между
продолжительностью периода напряжения и фазы асинхронного сокращения — фазу
изометрического сокращения (6).
|
|
|
Рис. 7.9. Критерии разделения цикла сердца на фазы. Объяснение в
тексте.
|
7.1.2.2. Сердечный выброс
Основной физиологической функцией сердца является нагнетание крови в
сосудистую систему.
Количество крови, выбрасываемой желудочком сердца в минуту, является одним из
важнейших показателей функционального состояния сердца и называется
минутным объемом крови (МОК). Он одинаков для правого и левого
желудочков. Когда человек находится в состоянии покоя, МОК составляет в среднем
4,5—5,0 л. Разделив минутный объем на число сокращений сердца в минуту, можно
вычислить систолический объем крови. При ритме сердечных сокращений
70—75 в минуту систолический объем равен 65—70 мл крови. Следует заметить, что в
покое в систолу из желудочков изгоняется примерно половина находящейся в них
крови. Это создает резервный объем, который может быть мобилизован
при необходимости быстрого и значительного увеличения сердечного выброса.
Принято так же рассчитывать величину сердечного индекса,
представляющего собой отношение МОК в л/мин к поверхности тела в
м2. Средняя величина этого показателя для "стандартного" мужчины
равна 3 л/мин*м2. Минутный и систолический объемы крови и сердечный
индекс объединяются общим понятием — сердечный выброс.
Наиболее точный способ определения минутного объема кровотока у человека
предложен Фиком (1870). Он состоит в косвенном вычислении МОК, которое
производят, зная разницу между содержанием кислорода в артериальной и
венозной крови, объем кислорода, потребляемого человеком в минуту.
Допустим, что в 1 мин через легкие в кровь поступило 400 мл кислорода и
количество кислорода в артериальной крови на 8 об.% больше, чем в венозной. Это
означает, что каждые 100 мл крови поглощают в легких 8 мл кислорода;
следовательно, чтобы усвоить все количество кислорода, который поступил через
легкие в кровь за минуту (в нашем примере 400 мл), необходимо, чтобы через
легкие прошло 100*400/8=5000 мл крови. Это количество крови и составляет
МОК, который в данном случае равен 5000 мл.
При использовании метода Фика необходимо брать смешанную венозную кровь из
правой половины сердца. Венозную кровь у человека берут из правой половины
сердца при помощи катетера, вводимого в правое предсердие через плечевую вену.
Метод Фика, являясь наиболее точным, не получил широкого распространения в
практике из-за технической сложности и трудоемкости (необходимость
катетеризации сердца, пунктирование артерии, определение газообмена).
Для определения МОК разработан ряд других методов. Многие из них основаны на
принципе разведения индикаторов, который состоит в том, что находят разведение и
скорость циркуляции какого-либо вещества, введенного в вену. В настоящее время
широко применяют некоторые краски и радиоактивные вещества. Введенное в вену
вещество проходит через правые отделы сердца, малый круг кровообращения, левые
отделы сердца и поступает в артерии большого круга кровообращения, где и
определяют его концентрацию. Сначала она волнообразно нарастает, затем падает.
Через некоторое время, когда порция крови, содержавшая максимальное количество
вещества, вторично пройдет через левые отделы сердца, его концентрация в
артериальной крови вновь немного увеличивается (так называемая волна
рециркуляции). Замечают время от момента введения вещества до начала
рециркуляции и вычерчивают кривую разведения, т. е. изменения концентрации
(нарастания и убыли) исследуемого вещества в крови. Зная количество вещества,
введенного в кровь и содержащегося в артериальной крови, а также время,
потребовавшееся на прохождение всего количества введенного вещества через
систему кровообращения, можно вычислить минутный объем кровотока в л/мин по
формуле:
МОК=60*J/C*T,
где J — количество введенного вещества, мг; С — средняя
концентрация вещества, вычисленная по кривой разведения, мг/л; Т —
длительность первой волны циркуляции, с.
Используют также метод интегральной реографии. Реография
(импендансография) — метод регистрации электрического сопротивления тканей
человеческого тела электрическому току, пропускаемому через тело. Чтобы не
вызвать повреждения тканей, используют токи сверхвысокой частоты и очень
небольшой силы. Сопротивление крови значительно меньше, чем сопротивление
тканей, поэтому увеличение кровенаполнения тканей значительно снижает их
электрическое сопротивление. Если регистрировать суммарное электрическое
сопротивление грудной клетки в нескольких направлениях, то периодические
резкие уменьшения его возникают в момент выброса сердцем в аорту и легочную
артерию систолического объема крови. При этом величина уменьшения сопротивления
пропорциональна величине систолического выброса. Помня об этом и используя
формулы, учитывающие размеры тела, особенности конституции и т. д., можно по
реографическим кривым определить величину систолического объема крови, а умножив
ее на число сердечных сокращений, — получить величину МОК. В кардиохирургической
практике для определения МОК используют методы оценки объемной скорости
кровотока в аорте, так как через аорту протекает весь МОК, за исключением
коронарного кровотока. Методы определения объемной скорости потока в
сосудах (ультразвуковая и электромагнитная флоуметрия) описаны ниже.
Сердечно-легочный препарат. Влияние различных условий на величину
систолического объема крови можно исследовать в остром опыте на
сердечно-легочном препарате (рис. 7.10).
|
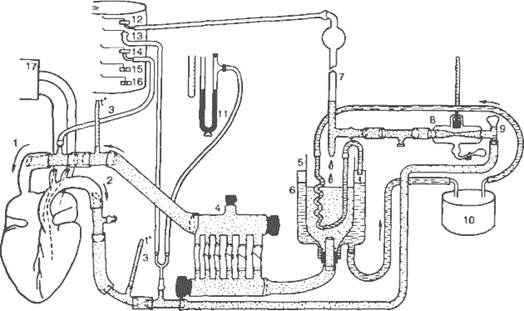
|
|
Рис. 7.10. Сердечно-легочный препарат (по В.М.Покровскому). 1 —
краниальная вена с венозной канюлей; 2 — аорта с аортальной канюлей; 3 —
термометры; 4 — дозирующее устройство; 5 — венозный резервуар крови; б —
водяная баня; 7 — волюметр; 8 — имитатор артериального сопротивления; 9 —
демпфер; 10 — ультратермостат; 11 — ртутный манометр для измерения
среднего давления; 12 — регистратор минутного объема; 13 — регистратор
«артериального» давления; 14 — регистратор «венозного» давления; 15 —
отметчик раздражения; 16 — отметчик времени; 17 — электроманометр.
|
У животного большой круг кровообращения заменяют искусственным. Венечное
кровообращение, а также малый круг кровообращения (через легкие) сохраняют
неповрежденными. В аорту и полую вену вводят канюли, которые соединяют с
системой пластиковых сосудов и трубок. Кровь, выбрасываемая левым
желудочком в аорту, течет по этой искусственной системе, поступает в полые вены,
затем в правое предсердие и правый желудочек. Отсюда она направляется в легочный
круг. Пройдя легкие, которые вентилируют аппаратом искусственного дыхания,
кровь, обогащенная О2 и отдавшая СО2, так же
как и в нормальных условиях, возвращается в левое сердце, откуда она вновь течет
в искусственный большой круг кровообращения.
В остром опыте имеется возможность увеличивать или уменьшать приток крови к
правому предсердию, меняя сопротивление, встречаемое кровью в искусственном
большом круге кровообращения. Таким образом, сердечно-легочный препарат
позволяет по желанию изменять нагрузку на сердце.
Опыты с сердечно-легочным препаратом позволили Старлингу установить «закон
сердца» (закон Франка — Старлинга): при увеличении кровенаполнения сердца в
диастолу и, следовательно, при увеличении растяжения мышцы сердца сила сердечных
сокращений возрастает. В условиях целостного организма действие закона
Франка — Старлинга ограничено влиянием других механизмов регуляции
деятельности сердца.
Изменение минутного объема крови при работе. Систолический и минутный
объемы кровотока — величины непостоянные. Их значения изменяются в зависимости
от того, в каких условиях находится организм, и какую работу он совершает. При
мышечной работе отмечается значительное увеличение МОК до 25—30 л, что может
быть обусловлено учащением сердечных сокращений и увеличением систолического
объема за счет использования резервного объема. У нетренированных лиц МОК
увеличивается обычно за счет учащения ритма сердечных сокращений. У
тренированных при работе средней тяжести происходит увеличение систолического
объема и гораздо меньшее, чем у нетренированных, учащение ритма сердечных
сокращений. В случае очень тяжелой работы, например при требующих огромного
мышечного напряжения спортивных соревнованиях, даже у хорошо тренированных
спортсменов наряду с увеличением систолического объема отмечается учащение
сердечных сокращений, а следовательно, и увеличение кровоснабжения
работающих мышц, в результате чего создаются условия, обеспечивающие большую
работоспособность. Число сердечных сокращений у тренированных может
достигать при большой нагрузке 200—220 в минуту.
7.1.2.3. Механические и
звуковые проявления сердечной деятельности
Сердечные сокращения сопровождаются рядом механических и звуковых проявлений,
регистрируя которые, можно получить представление о динамике сокращения
сердца. В пятом межреберье слева, на 1 см кнутри от среднеключичной линии, в
момент сокращения сердца ощущается верхушечный толчок.
В период диастолы сердце напоминает эллипсоид, ось которого направлена сверху
вниз и справа налево. При сокращении желудочков форма сердца приближается к
шару, при этом продольный диаметр сердца уменьшается, а поперечный возрастает.
Уплотненный миокард левого желудочка касается внутренней поверхности
грудной стенки. Одновременно опущенная к диафрагме при диастоле верхушка сердца
в момент систолы приподнимается и ударяется о переднюю стенку грудной клетки.
Все это вызывает появление верхушечного толчка.
Для анализа механической активности сердца используют ряд специальных
методов.
Кинетокардиография — метод регистрации низкочастотных вибраций грудной
клетки, обусловленных механической деятельностью сердца. С этой целью
применяют датчики, обеспечивающие преобразование механических колебаний в
электрические. Кинетокардиография позволяет изучить фазовую структуру цикла
левого и правого желудочков сердца одновременно.
Электрокимография является электрической регистрацией движения контура
сердечной тени на экране рентгеновского аппарата. К экрану у краев контура
сердца в области предсердия, желудочка или аорты прикладывают фотоэлемент,
соединенный с осциллографом. При движениях сердца изменяется
освещенность фотоэлемента, что регистрируется осциллографом в виде кривой.
Так получают кривые сокращения и расслабления отделов сердца.
Баллистокардиография основана на том, что изгнание крови из желудочков и
ее движение в крупных сосудах вызывают колебания всего тела, зависящие от
явлений реактивной отдачи, подобных тем, которые наблюдаются при выстреле из
пушки (название методики «баллистокардиография» происходит от слова «баллиста» —
метательный снаряд). Кривые смещений тела, записываемые баллистокардиографом и
зависящие от работы сердца, имеют в норме характерный вид. Для их
регистрации существует несколько различных способов и приборов.
Динамокардиография разработана Е. Б. Бабским и сотр. Эта методика регистрации
механических проявлений сердечной деятельности человека основана на том, что
движения сердца в грудной клетке и перемещение крови из сердца в сосуды
сопровождаются смещением центра тяжести грудной клетки по отношению к
той поверхности, на которой лежит человек. Обследуемый лежит на специальном
столе, на котором смонтировано особое устройство с датчиками — преобразователями
механических величин в электрические колебания. Устройство.находится под
грудной клеткой исследуемого. Смещения центра тяжести регистрируются
осциллографом в виде кривых. На динамокардиограмме отмечаются все фазы
сердечного цикла: систола предсердий, периоды напряжения желудочков и
изгнания из них крови, протодиастолический период, периоды расслабления и
наполнения желудочков кровью.
Эхокардиография — метод исследования механической деятельности и
структуры сердца, основанный на регистрации отраженных сигналов импульсного
ультразвука. При этом ультразвук в форме высокочастотных посылок (до 2,25—3 мГц)
проникает в тело человека, отражается на границе раздела сред с различным
ультразвуковым сопротивлением и воспринимается прибором. Изображение
эхосигналов от структур сердца воспроизводится на экране осциллографа и
регистрируется на фотопленке. Эхокардиограмма (ЭхоКГ) имеет вид ряда кривых,
каждая точка которых отражает положение структур сердца в данный момент времени.
ЭхоКГ всегда регистрируется синхронно с ЭКГ, что позволяет производить оценку
механической активности сердца в определенные фазы сердечного цикла.
При работе сердца возникают звуки, которые называют тонами сердца. При
выслушивании (аускультации) тонов сердца на поверхности левой половины
грудной клетки слышны два тона: I тон (систолический), II тон — в начале
диастолы (диастолический). Тон I более протяжный и низкий, II — короткий и
высокий.
Детальный анализ тонов сердца стал возможным благодаря применению
электронной аппаратуры. Если к груди обследуемого приложить чувствительный
микрофон, соединенный с усилителем и осциллографом, можно зарегистрировать тоны
сердца в виде кривых — фонокардиограммы (ФКГ). Эта методика называется
фонокардиографией (см. рис. 7.9).
Сужение клапанных отверстий или неплотное смыкание створок и лепестков
клапанов вызывает появление сердечных шумов, возникающих вследствие
вихреобразного (турбулентного) движения крови через отверстия клапанов. Эти шумы
имеют важное диагностическое значение при поражениях клапанов сердца.
На ФКГ, помимо I и II тонов, регистрируются III и IV тоны сердца (более
тихие, чем I и II, поэтому неслышные при обычной аускультации).
Тон III возникает вследствие вибрации стенки желудочков при быстром притоке
крови в желудочки в начале их наполнения.
Тон IV имеет два компонента. Первый из них возникает при сокращении миокарда
предсердий, а второй появляется в самом начале расслабления предсердий и падения
давления в них.
К внешним проявлениям деятельности сердца относят артериальный пульс,
характер которого отражает не только деятельность сердца, но и
функциональные состояния артериальной системы. Артериальный пульс отражает ритм
сердца, скорость изгнания крови левым желудочком и величину систолического
объема, т. е. факторы, определяющие кинетическую энергию выброшенной
сердцем крови. Это в какой-то мере позволяет судить о силе сердечных
сокращений.
7.1.3. Регуляция деятельности
сердца
Сердце человека, непрерывно работая, даже при спокойном образе жизни
нагнетает в артериальную систему около Ют крови в сутки, 4000 т в год и около
300 000 т за всю жизнь. При этом сердце всегда точно реагирует на потребности
организма, поддерживая постоянно необходимый уровень кровотока.
Приспособление деятельности сердца к изменяющимся потребностям организма
происходит при помощи ряда регуляторных механизмов. Часть из них
расположена в самом сердце — это внутрисердечные регуляторные механизмы.
К ним относятся внутриклеточные механизмы регуляции, регуляция
межклеточных взаимодействий и нервные механизмы — внутрисердечные рефлексы.
Вторая группа представляет собой внесердечные регуляторные механизмы. В
эту группу входят экстракардиальные нервные и гуморальные механизмы регуляции
сердечной деятельности.
7.1.3.1. Внутрисердечные
регуляторные механизмы
Внутриклеточные механизмы регуляции. Электронная микроскопия
позволила установить, что миокард не является синцитием, а состоит из отдельных
клеток — миоцитов, соединяющихся между собой вставочными дисками. В каждой
клетке действуют механизмы регуляции синтеза белков, обеспечивающих сохранение
ее структуры и функций. Скорость синтеза каждого из белков регулируется
собственным ауторегуляторным механизмом, поддерживающим уровень
воспроизводства данного белка в соответствии с интенсивностью его
расходования.
При увеличении нагрузки на сердце (например, при регулярной мышечной
деятельности) синтез сократительных белков миокарда и структур, обеспечивающих
их деятельность, усиливается. Появляется так называемая рабочая
(физиологическая) гипертрофия миокарда, наблюдающаяся у спортсменов.
Внутриклеточные механизмы регуляции обеспечивают и изменение
интенсивности деятельности миокарда в соответствии с количеством
притекающей к сердцу крови. Этот механизм получил название «закон сердца»
(закон Франка—Старлинга): сила сокращения сердца (миокарда)
пропорциональна степени его кровенаполнения в диастолу (степени
растяжения), т. е. исходной длине его мышечных волокон. Более сильное растяжение
миокарда в момент диастолы соответствует усиленному притоку крови к сердцу.
При этом внутри каждой миофибриллы актиновые нити в большей степени выдвигаются
из промежутков между миозиновыми иитями, а значит, растет количество резервных
мостиков, т. е. тех актиновых точек, которые соединяют актиновые и миозиновые
нити в момент сокращения. Следовательно, чем больше растянута каждая клетка
миокарда во время диастолы, тем больше она сможет укоротиться во время систолы.
По этой причине сердце перекачивает в артериальную систему то количество
крови, которое притекает к нему из вен. Такой тип миогенной регуляции
сократимости миокарда получил название гетерометрической (т. е.
зависимой от переменной величины — исходной длины волокон миокарда)
регуляции. Под гомеометрической регуляцией принято понимать
изменения силы сокращений при неменяющейся исходной длине волокон миокарда. Это
прежде всего ритмозависимые изменения силы сокращений. Если стимулировать
полоску миокарда при равном растяжении с все увеличивающейся частотой, то можно
наблюдать увеличение силы каждого последующего сокращения («лестница» Боудича).
В качестве теста на гомеометрическую регуляцию используют также пробу
Анрепа — резкое увеличение сопротивления выбросу крови из левого желудочка в
аорту. Это приводит к увеличению в определенных границах силы сокращений
миокарда. При проведении пробы выделяют две фазы. Вначале при увеличении
сопротивления выбросу крови растет конечный диастолический объем и увеличение
силы сокращений реализуется по гетерометрическому механизму. На втором этапе
конечный диастолический объем стабилизируется и возрастание силы сокращений
определяется гомеометрическим механизмом.
Регуляция межклеточных взаимодействий. Установлено, что вставочные
диски, соединяющие клетки миокарда, имеют различную структуру. Одни участки
вставочных дисков выполняют чисто механическую функцию, другие обеспечивают
транспорт через мембрану кардиомиоцита необходимых ему веществ, третьи —
нексусы, или тесные контакты, проводят возбуждение с клетки на
клетку. Нарушение межклеточных взаимодействий приводит к асинхронному
возбуждению клеток миокарда и появлению сердечных аритмий.
К межклеточным взаимодействиям следует отнести и взаимоотношения
кардиомиоцитов с соединительнотканными клетками миокарда. Последние
представляют собой не просто механическую опорную структуру. Они поставляют
для сократительных клеток миокарда ряд сложных высокомолекулярных
продуктов, необходимых для поддержания структуры и функции сократительных
клеток. Подобный тип межклеточных взаимодействий получил название креаторных
связей (Г. И. Косицкий).
Внутрисердечные периферические рефлексы. Более высокий уровень
внутриорганной регуляции деятельности сердца представлен внутрисердечными
нервными механизмами. Обнаружено, что в сердце возникают так называемые
периферические рефлексы, дуга которых замыкается не в ЦНС, а в
интрамуральных ганглиях миокарда. После гомотрансплантации сердца теплокровных
животных и дегенерации всех нервных элементов экстракардиального
происхождения в сердце сохраняется и функционирует внутриорганная нервная
система, организованная по рефлекторному принципу. Эта система
включает афферентные нейроны, дендриты которых образуют рецепторы
растяжения на волокнах миокарда и венечных (коронарных) сосудах, вставочные и
эфферентные нейроны. Аксоны последних иннервируют миокард и гладкие мышцы
коронарных сосудов. Указанные нейроны соединяются между собой синаптическими
связями, образуя внутри-сердечные рефлекторные дуги.
В экспериментах показано, что увеличение растяжения миокарда правого
предсердия (в естественных условиях оно возникает при увеличении притока крови к
сердцу) приводит к усилению сокращений миокарда левого желудочка. Таким
образом, усиливаются сокращения не только того отдела сердца, миокард которого
непосредственно растягивается притекающей кровью, но и других отделов,
чтобы «освободить место» притекающей крови и ускорить выброс ее в артериальную
систему. Доказано, что эти реакции осуществляются с помощью внутрисердечных
периферических рефлексов (Г. И. Косицкий).
Подобные реакции наблюдаются лишь на фоне низкого исходного
кровенаполнения сердца и незначительной величины давления крови в устье аорты и
коронарных сосудах. Если камеры сердца переполнены кровью и давление в устье
аорты и коронарных сосудах высокое, то растяжение венозных приемников в сердце
угнетает сократительную активность миокарда, в аорту выбрасывается меньшее
количество крови, а приток крови из вен затрудняется. Подобные реакции
играют важную роль в регуляции кровообращения, обеспечивая стабильность
кровенаполнения артериальной системы.
Гетерометрический и гомеометрический механизмы регуляции силы сокращения
миокарда могут привести лишь к резкому увеличению энергии сердечного
сокращения в случае внезапного повышения притока крови из вен или повышения
артериального давления. Казалось бы, что при этом артериальная система не
защищена от губительных для нее внезапных мощных ударов крови. В
действительности же таких ударов не возникает благодаря защитной роли,
осуществляемой рефлексами внутрисердечной нервной системы.
Переполнение камер сердца притекающей кровью (равно как и значительное
повышение давления крови в устье аорты, коронарных сосудов) вызывает
снижение силы сокращений миокарда посредством внутрисердечных периферических
рефлексов. Сердце при этом выбрасывает в артерии в момент систолы меньшее, чем в
норме, количество содержащейся в желудочках крови. Задержка даже небольшого
дополнительного объема крови в камерах сердца повышает диастолическое давление в
его полостях, что вызывает снижение притока венозной крови к сердцу. Излишний
объем крови, который при внезапном выбросе его в артерии мог бы вызвать пагубные
последствия, задерживается в венозной системе.
Опасность для организма представляло бы и уменьшение сердечного выброса,
что могло бы вызвать критическое падение артериального давления. Такую
опасность также предупреждают регу-ляторные реакции внутрисердечной системы.
Недостаточное наполнение кровью камер сердца и коронарного русла вызывает
усиление сокращений миокарда посредством внутрисердечных рефлексов. При
этом желудочки в момент систолы выбрасывают в аорту большее, чем в норме,
количество содержащейся в них крови. Это и предотвращает опасность
недостаточного наполнения кровью артериальной системы. К моменту
расслабления желудочки содержат меньшее, чем в норме, количество крови, что
способствует усилению притока венозной крови к сердцу.
В естественных условиях внутрисердечная нервная система не является
автономной. Она — лишь низшее звено сложной иерархии нервных механизмов,
регулирующих деятельность сердца. Следующим, более высоким звеном этой
иерархии являются сигналы, поступающие по блуждающим и симпатическим нервам,
осуществляющие процессы экстракардиальной нервной регуляции сердца.
7.1.3.2. Внесердечные
регуляторные механизмы
Нервная экстракардиальная регуляция. Эта регуляция осуществляется
импульсами, поступающими к сердцу из ЦНС по блуждающим и симпатическим
нервам.
Подобно всем вегетативным нервам, сердечные нервы образованы двумя нейронами.
Тела первых нейронов, отростки которых составляют блуждающие нервы
(парасимпатический отдел автономной нервной системы), расположены в
продолговатом мозге (рис. 7.11). Отростки этих нейронов заканчиваются в
интрамуральных ганглиях сердца. Здесь находятся вторые нейроны, отростки которых
идут к проводящей системе, миокарду и коронарным сосудам.
|
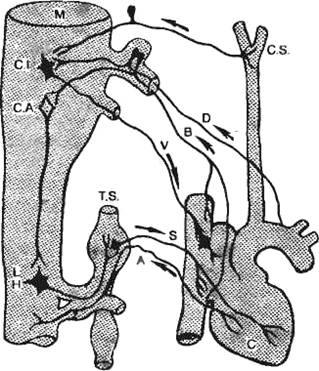
|
|
Рис. 7.11. Экстракардиальные нервы сердца.
С — сердце; М — продолговатый мозг; С.I. — ядро, вызывающее торможение
деятельности сердца; С.А. — ядро, вызывающее учащение сердечной
деятельности; L.H. — боковой рог спинного мозга; Т.S. — симпатический
ствол; V — эфферентные волокна блуждающего нерва; D — нерв «депрессор»
(афферентные волокна блуждающего нерва); S — симпатические волокна; А —
спинномозговые афферентные волокна; С. S. — каротидный синус; В —
афферентные волокна от правого предсердия и полой
вены.
|
Первые нейроны симпатической части автономной нервной системы,
передающие импульсы к сердцу, расположены в боковых рогах пяти верхних сегментов
грудного отдела спинного мозга. Отростки этих нейронов заканчиваются в шейных и
верхних грудных симпатических узлах. В этих узлах находятся вторые нейроны,
отростки которых идут к сердцу. Большая часть симпатических нервных
волокон, иннервирующих сердце, отходит от звездчатого узла.
Влияние на сердце блуждающих нервов впервые изучили братья Вебер (1845). Они
установили, что раздражение этих нервов тормозит работу сердца вплоть до полной
его остановки в диастолу. Это был первый случай обнаружения в организме
тормозящего влияния нервов.
При электрическом раздражении периферического отрезка перерезанного
блуждающего нерва происходит урежение сердечных сокращений. Это явление
называется отрицательным хронотропным эффектом. Одновременно отмечается
уменьшение амплитуды сокращений — отрицательный инотропный
эффект.
При сильном раздражении блуждающих нервов работа сердца на некоторое
время прекращается. В этот период возбудимость мышцы сердца
понижена. Понижение возбудимости мышцы сердца называется отрицательным
батмотропным эффектом. Замедление проведения возбуждения в сердце
называется отрицательным дромотропным эффектом. Нередко наблюдается
полная блокада проведения возбуждения в предсердно-желудочковом узле.
Микроэлектродные отведения потенциалов от одиночных мышечных волокон
предсердий показали увеличение мембранного потенциала — гиперполяризацию
при сильном раздражении блуждающего нерва (рис. 7.12).
|
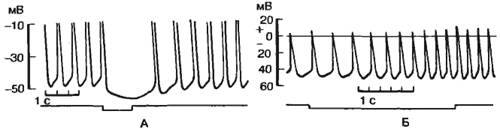
|
|
Рис. 7.12. Потенциалы действия клетки — водителя ритма сердца
лягушки при раздражении блуждающего (А) и симпатического (Б) нервов.
На рисунке А показана только нижняя
половина потенциала действия.
|
При продолжительном раздражении блуждающего нерва прекратившиеся вначале
сокращения сердца восстанавливаются, несмотря на продолжающееся раздражение. Это
явление называют ускользанием сердца из-под влияния блуждающего
нерва.
Влияние на сердце симпатических нервов впервые было изучено братьями Цион
(1867), а затем И. П. Павловым. Ционы описали учащение сердечной деятельности
при раздражении симпатических нервов сердца (положительный хронотропный
эффект); соответствующие волокна они назвали nn. accelerantes cordis
(ускорители сердца).
При раздражении симпатических нервов ускоряется спонтанная деполяризация
клеток — водителей ритма в диастолу, что ведет к учащению сердечных
сокращений.
Раздражение сердечных ветвей симпатического нерва улучшает проведение
возбуждения в сердце (положительный дромотропный эффект) и повышает
возбудимость сердца (положительный батмотропный эффект). Влияние
раздражения симпатического нерва наблюдается после большого латентного периода
(10 с и более) и продолжается еще долго после прекращения раздражения нерва.
И. П. Павлов (1887) обнаружил нервные волокна (усиливающий нерв), усиливающие
сердечные сокращения без заметного учащения ритма (положительный инотропный
эффект).
Инотропный эффект «усиливающего» нерва хорошо виден при регистрации
внутрижелудочкового давления электроманометром. Выраженное влияние
«усиливающего» нерва на сократимость миокарда проявляется особенно при
нарушениях сократимости. Одной из таких крайних форм нарушения сократимости
является альтернация сердечных сокращений, когда одно «нормальное» сокращение
миокарда (в желудочке развивается давление, превышающее давление в аорте и
осуществляется выброс крови из желудочка в аорту) чередуется со «слабым»
сокращением миокарда, при котором давление в желудочке в систолу не
достигает давления в аорте и выброса крови не происходит. «Усиливающий» нерв не
только усиливает обычные сокращения желудочков, но и устраняет
альтернацию, восстанавливая неэффективные сокращения до обычных (рис.
7.13). По мнению И. П. Павлова, эти волокна являются специально
трофическими, т. е. стимулирующими процессы обмена веществ.
Совокупность приведенных данных позволяет представить влияние нервной
системы на ритм сердца как корригирующее, т. е. ритм сердца зарождается в его
водителе ритма, а нервные влияния ускоряют или замедляют скорость спонтанной
деполяризации клеток водителя ритма, ускоряя или замедляя таким образом частоту
сердцебиений.
В последние годы стали известны факты, свидетельствующие о возможности не
только корригирующих, но и пусковых влияний нервной системы на ритм сердца,
когда сигналы, приходящие по нервам, инициируют сокращения сердца. Это можно
наблюдать в опытах с раздражением блуждающего нерва в режиме, близком к
естественной импульсации в нем, т. е. «залпами» («пачками») импульсов, а не
непрерывным потоком, как это делалось традиционно. При раздражении блуждающего
нерва «залпами» импульсов сердце сокращается в ритме этих «залпов» (каждому
«залпу» соответствует одно сокращение сердца). Меняя частоту и характеристику
«залпов», можно управлять ритмом сердца в широких пределах.
|
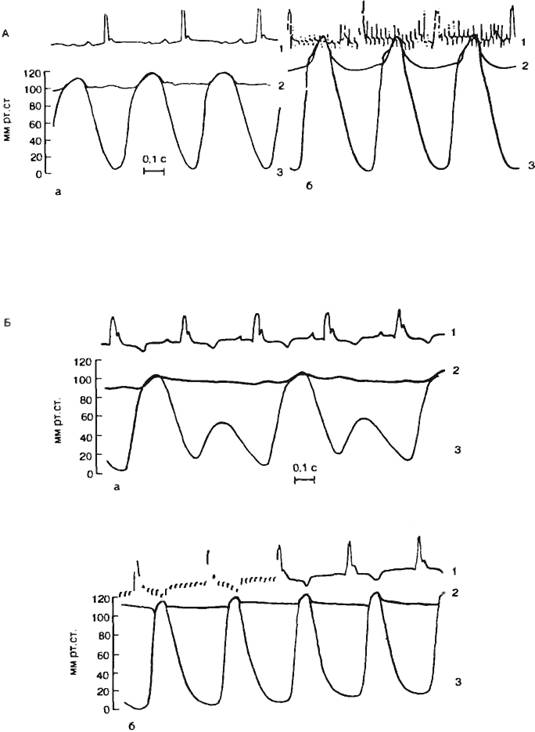
|
|
Рис. 7.13. Влияние «усиливающего» нерва на сердце (по В. М
Покровскому).
А — влияние «усиливающего нерва» на динамику сокращений сердца; Б —
устранение «усиливающим» нервом альтернации силы сокращений сердца; а — до
раздражения, б — во время раздражения нерва. 1 — ЭКГ; 2 — давление в
аорте; 3 — давление в левом желудочке до раздражения и
во время раздражения нерва.
|
Воспроизведение сердцем центрального ритма резко изменяет
электрофизиологические параметры деятельности синоатриального узла. При работе
узла в режиме автоматии, а также при изменениях частоты под влиянием раздражения
блуждающего нерва в традиционном режиме возбуждение возникает в одной точке
узла, в случае воспроизведения центрального ритма в инициации возбуждения
принимает участие одновременно множество клеток узла. На изохронной карте
движения возбуждения в узле этот процесс отражается не в виде точки, а в
виде большой площади, образованной одновременно возбуждающимися структурными
элементами. Сигналы, обеспечивающие синхронное воспроизведение сердцем
центрального ритма, отличаются по своей медиаторной природе от
общетормозных влияний блуждающего нерва. По-видимому, выделяющиеся в этом
случае наряду с ацетилхолином регуляторные пептиды отличаются по своему
составу, т. е. реализация каждого типа эффектов блуждающего нерва обеспечивается
своей смесью медиаторов («медиаторные коктейли»).
С целью изменения частоты посылки «пачек» импульсов из сердечного центра
продолговатого мозга у людей можно воспользоваться такой моделью. Человеку
предлагают дышать чаще, чем сокращается его сердце. Для этого он следит за
миганием лампочки фотостимулятора и на каждую вспышку света
производит одно дыхание. Фотостимулятор устанавливается с частотой,
превышающей исходную частоту сердцебиений. За счет иррадиации
возбуждения с дыхательных на сердечные нейроны в продолговатом мозге в
сердечных эфферентных нейронах блуждающего нерва формируются «пачки»
импульсов в новом, общем для дыхательных и сердечных центров, ритме. При
этом синхронизация ритмов дыхания и сердцебиения достигается за счет «залпов»
импульсов, приходящих к сердцу по блуждающим нервам. В опытах на собаках феномен
синхронизации дыхательных и сердечных ритмов наблюдается при резком учащении
дыхания во время перегревания. Как только ритм учащающегося дыхания станет
равным частоте сердцебиений, оба ритма синхронизируются и учащаются или
урежаются в определенном диапазоне синхронно. Если при этом нарушить проведение
сигналов по блуждающим нервам посредством их перерезки или холодовой блокады, то
синхронизация ритмов исчезнет. Следовательно, и в этой модели сердце
сокращается под влиянием «залпов» импульсов, приходящих к нему по блуждающим
нервам.
Совокупность изложенных экспериментальных фактов позволила сформировать
представление о существовании наряду с внут-рисердечным и центрального
генератора ритма сердца (В. М. Покровский). При этом последний в
естественных условиях формирует адаптивные (приспособительные) реакции
сердца, воспроизводя ритм сигналов, приходящих к сердцу по блуждающим
нервам. Внутрисердечный генератор обеспечивает поддержание жизни за счет
сохранения насосной функции сердца в случае выключения центрального генератора
при наркозе, ряде заболеваний, обмороке и т. д.
|
|
|
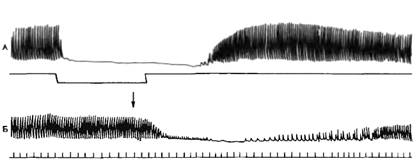
Рис. 7.14. Влияние раздражения Блуждающего нерва на
сердце лягушки. Л — запись
сокращения изолированного
сердца, под кривой
— отметка раздражения блуждающего
нерва; Б — запись
сокращений второго изолированного
сердца. Стрелкой отмечен момент
переноса жидкости, питавшей
первое сердце во время
раздражения, во второе сердце.
|
Химический механизм передачи нервных импульсов в сердце. При раздражении
периферических отрезков блуждающих нервов в их окончаниях в сердце выделяется
АХ, а при раздражении симпатических нервов — норадреналин. Эти вещества
являются непосредственными агентами, вызывающими торможение или усиление
деятельности сердца, и поэтому получили название медиаторов (передатчиков)
нервных влияний. Существование медиаторов было показано Леви (1921). Он
раздражал блуждающий или симпатический нерв изолированного сердца лягушки, а
затем переносил жидкость из этого сердца в другое, тоже изолированное, но не
подвергавшееся нервному влиянию — второе сердце давало такую же реакцию (рис.
7.14, 7.15). Следовательно, при раздражении нервов первого сердца в питающую его
жидкость переходит соответствующий медиатор. На нижних кривых можно видеть
эффекты, вызываемые перенесенным раствором Рингера, находившимся в сердце во
время раздражения.
|

|
|
Рис. 7.15. Влияние раздражения симпатического нерва на сердце
лягушки (по В. Б. Болдыреву).
А — резкое усиление и учащение сердечных сокращений при
раздражении симпатического
нерва (отметка раздражения на нижней линии);
Б — действие физиологического раствора,
взятого из первого сердца во время
стимуляции симпатического нерва, на второе
сердце,
не подвергавшееся раздражению.
|
АХ, образующийся в окончаниях блуждающего нерва, быстро разрушается
ферментом холинэстеразой, присутствующим в крови и клетках, поэтому АХ оказывает
только местное действие. Норадреналин разрушается значительно медленнее,
чем АХ, и потому действует дольше. Этим объясняется то, что после прекращения
раздражения симпатического нерва в течение некоторого времени сохраняются
учащение и усиление сердечных сокращений.
Получены данные, свидетельствующие о том, что при возбуждении наряду с
основным медиаторным веществом в синаптическую щель поступают и другие
биологически активные вещества, в частности пептиды. Последние обладают
модулирующим действием, изменяя величину и направленность реакции сердца на
основной медиатор. Так, опиоидные пептиды угнетают эффекты раздражения
блуждающего нерва, а пептид дельта-сна усиливает вагусную брадикардию.
7.1.3.3. Взаимодействие
внутрисердечных и внесердечных нервных регуляторных механизмов
Центры блуждающих и симпатических нервов являются второй ступенью иерархии
нервных центров, регулирующих работу сердца. Интегрируя рефлекторные и
нисходящие из высших отделов головного мозга влияния, они формируют
сигналы, управляющие деятельностью сердца, в том числе определяющие ритм
его сокращений. Более высокая ступень этой иерархии — центры гипоталамической
области. При электрическом раздражении различных зон гипоталамуса
наблюдаются реакции сердечно-сосудистой системы, по силе и выраженности намного
превосходящие реакции, возникающие в естественных условиях. При локальном
точечном раздражении некоторых пунктов гипоталамуса удавалось наблюдать
изолированные реакции: изменение ритма сердца, или силы сокращений левого
желудочка, или степени расслабления левого желудочка и т. д. Таким образом,
удалось выявить, что в гипоталамусе имеются структуры, способные
регулировать отдельные функции сердца. В естественных условиях эти
структуры не работают изолированно. Гипоталамус представляет собой
интегративный центр, который может изменять любые параметры сердечной
деятельности и состояние любых отделов сердечно-сосудистой системы с тем, чтобы
обеспечить потребности организма при поведенческих реакциях, возникающих в ответ
на изменение условий окружающей (и внутренней) среды.
Гипоталамус является лишь одним из уровней иерархии центров, регулирующих
деятельность сердца. Он — исполнительный орган, обеспечивающий интегративную
перестройку функций сердечно-сосудистой системы (и других систем) организма
по сигналам, поступающим из расположенных выше отделов мозга — лимбической
системы или новой коры. Раздражение определенных структур лимбической
системы или новой коры наряду с двигательными реакциями изменяет функции
сердечно-сосудистой системы: артериальное давление, частоту сердечных
сокращений и т. д.
Анатомическая близость в коре большого мозга центров, ответственных за
возникновение двигательных и сердечно-сосудистых реакций, способствует
оптимальному вегетативному обеспечению поведенческих реакций организма.
7.1.3.4. Рефлекторная
регуляция деятельности сердца
Осуществляется при участии всех перечисленных отделов ЦНС. Рефлекторные
реакции могут как тормозить (замедлять и ослаблять), так и возбуждать (ускорять
и усиливать) сердечные сокращения.
Рефлекторные изменения работы сердца возникают при раздражении различных
рецепторов. Особое значение в регуляции работы сердца имеют рецепторы,
расположенные в некоторых участках сосудистой системы. Эти рецепторы
возбуждаются при изменении давления крови в сосудах или при воздействии
гуморальных (химических) раздражителей. Участки, где сосредоточены такие
рецепторы, получили название сосудистых рефлексогенных зон. Наиболее
значительна роль рефлексогенных зон, расположенных в дуге аорты и в области
разветвления сонной артерии. Здесь находятся окончания центростремительных
нервов, раздражение которых рефлекторно вызывает урежение сердечных сокращений.
Эти нервные окончания представляют собой барорецепторы. Естественным их
раздражителем служит растяжение сосудистой стенки при повышении давления в
тех сосудах, где они расположены. Поток афферентных нервных импульсов от этих
рецепторов повышает тонус ядер блуждающих нервов, что приводит к замедлению
сердечных сокращений. Чем выше давление крови в сосудистой рефлексогенной зоне,
тем чаще возникают афферентные импульсы.
Рефлекторные изменения сердечной деятельности можно вызвать раздражением
рецепторов и других кровеносных сосудов. Например, при повышении давления в
легочной артерии замедляется работа сердца. Можно изменить сердечную
деятельность и путем раздражения рецепторов сосудов многих внутренних
органов.
Обнаружены также рецепторы в самом сердце: эндокарде, миокарде и
эпикарде; их раздражение рефлекторно изменяет и работу сердца, и тонус
сосудов.
В правом предсердии и в устьях полых вен имеются механорецепторы,
реагирующие на растяжение (при повышении давления в полости предсердия
или в полых венах). Залпы афферентных импульсов от этих рецепторов проходят по
центростремительным волокнам блуждающих нервов к группе нейронов ретикулярной
формации ствола мозга, получивших название «сердечно-сосудистый центр».
Афферентная стимуляция этих нейронов приводит к активации нейронов
симпатического отдела автономной нервной системы и вызывает рефлекторное
учащение сердечных сокращений. Импульсы, идущие в ЦНС от механорецепторов
предсердий, влияют и на работу других органов.
Классический пример вагального рефлекса описал в 60-х годах прошлого века
Гольц: легкое поколачивание по желудку и кишечнику лягушки вызывает
остановку или замедление сокращений сердца (рис. 7.16). Остановка сердца при
ударе по передней брюшной стенке наблюдалась также у человека.
Центростремительные пути этого рефлекса идут от желудка и кишечника по чревному
нерву в спинной мозг и достигают ядер блуждающих нервов в продолговатом
мозге. Отсюда начинаются центробежные пути, образованные ветвями блуждающих
нервов, идущими к сердцу. К числу вагальных рефлексов относится также
глазосердечный рефлекс Ашнера (урежение сердцебиений на 10—20 в минуту при
надавливании на глазные яблоки).
Рефлекторное учащение и усиление сердечной деятельности наблюдаются при
болевых раздражениях и эмоциональных состояниях: ярости, гневе, радости, а также
при мышечной работе. Изменения сердечной деятельности при этом вызываются
импульсами, поступающими к сердцу по симпатическим нервам, а также
ослаблением тонуса ядер блуждающих нервов.
|
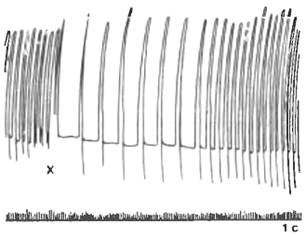
|
|
Рис. 7.16. Рефлекс Гольца у лягушки. Запись
сокращений сердца лягушки.
X — начало легкого поколачивания по кишечнику. Отметка
времени 1 с.
|
7.1.3.5.
Условнорефлекторная регуляция деятельности сердца
Тот факт, что различные эмоции вызывают изменение сердечной деятельности,
указывает на важное значение коры большого мозга в регуляции деятельности
сердца. Доказательством этого является то, что изменение ритма и силы сердечных
сокращений можно наблюдать у человека при одном упоминании или воспоминании о
факторах, вызывающих у него определенные эмоции.
Наиболее убедительные данные о наличии корковой регуляции деятельности сердца
получены экспериментально с помощью метода условных рефлексов. Если
какой-нибудь, например звуковой, раздражитель сочетать многократно с
надавливанием на глазные яблоки, вызывающим уменьшение частоты сердечных
сокращений, то затем один этот раздражитель вызывает урежение сердечной
деятельности — условный глазосердечный рефлекс.
Условнорефлекторные реакции лежат в основе тех явлений, которые
характеризуют так называемое предстартовое состояние спортсменов. Перед
соревнованием у них наблюдаются изменения дыхания, обмена веществ,
сердечной деятельности такого же характера, как и во время самого соревнования.
У конькобежцев на старте сердечный ритм увеличивается на 22—35 сокращений в
минуту.
Кора большого мозга обеспечивает приспособительные реакции организма не
только к текущим, но и к будущим событиям. По механизму условных рефлексов
сигналы, предвещающие наступление этих событий или значительную вероятность
их возникновения, могут вызвать перестройку функций сердца и всей
сердечно-сосудистой системы в той мере, в какой это необходимо, чтобы
обеспечить предстоящую деятельность организма.
При чрезвычайно сложных ситуациях (действие «чрезвычайных раздражителей», по
И. П. Павлову) возможны нарушения и срывы этих корковых высших регуляторных
механизмов (неврозы по И. П. Павлову). При этом наряду с расстройствами
поведенческих реакций (и невротическими изменениями психологического статуса
человека) могут появиться значительные нарушения деятельности сердца и
сердечно-сосудистой системы. В некоторых случаях эти нарушения могут закрепиться
по типу патологических условных рефлексов. При этом нарушения сердечной
деятельности могут возникнуть при действии одних лишь условных
сигналов.
7.1.3.6. Гуморальная
регуляция деятельности сердца
Изменения работы сердца наблюдаются при действии на него ряда биологически
активных веществ, циркулирующих в крови.
Катехоламины (адреналин, норадреналин) увеличивают силу и учащают
ритм сердечных сокращений, что имеет важное биологическое значение. При
физических нагрузках или эмоциональном напряжении мозговой слой
надпочечников выбрасывает в кровь большое количество адреналина, что приводит к
усилению сердечной деятельности, крайне необходимому в данных условиях.
Указанный эффект возникает в результате стимуляции катехоламинами рецепторов
миокарда, вызывающей активацию внутриклеточного фермента аденилатциклазы,
которая ускоряет образование 3',5'-циклического аденозинмонофосфата (цАМФ).
Он активирует фосфорилазу, вызывающую расщепление внутримышечного гликогена
и образование глюкозы (источника энергии для сокращающегося миокарда).
Кроме того, фосфорилаза необходима для активации ионов Са2+ — агента,
реализующего сопряжение возбуждения и сокращения в миокарде (это также
усиливает положительное инотропное действие катехоламинов). Помимо этого,
катехоламины повышают проницаемость клеточных мембран для ионов
Са2+, способствуя, с одной стороны, усилению поступления их из
межклеточного пространства в клетку, а с другой — мобилизации ионов
Са2+ из внутриклеточных депо.
Активация аденилатциклазы отмечается в миокарде и при действии глюкагона
— гормона, выделяемого α-клетками панкреатических островков, что
также вызывает положительный инотропный эффект.
Гормоны коры надпочечников, ангиотензин и серотонин также увеличивают силу
сокращений миокарда, а тироксин учащает сердечный ритм. Гипоксемия,
гиперкапния и ацидоз угнетают сократительную активность миокарда.
7.1.4. Эндокринная функция
сердца
Миоциты предсердий образуют атриопептид, или натрийуретический
гормон. Стимулируют секрецию этого гормона растяжение предсердий притекающим
объемом крови, изменение уровня натрия в крови, содержание в крови вазопрессина,
а также влияния экстракардиальных нервов. Натрийуретический гормон обладает
широким спектром физиологической активности. Он сильно повышает экскрецию
почками ионов Na+ и Сl-, подавляя их реабсорбцию в
канальцах нефронов. Влияние на диурез осуществляется также за счет увеличения
клубочковой фильтрации и подавления реабсорбции воды в канальцах.
Натрийуретический гормон подавляет секрецию ренина, ингибирует эффекты
ангиотензина II и альдостерона. Натрийуретический гормон расслабляет
гладкие мышечные клетки мелких сосудов, способствуя тем самым снижению
артериального давления, а также гладкую мускулатуру кишечника.
7.2. ФУНКЦИИ СОСУДИСТОЙ
СИСТЕМЫ
7.2.1. Основные принципы
гемодинамики. Классификация сосудов
Гемодинамика — раздел науки, изучающий механизмы движения крови в
сердечно-сосудистой системе. Он является частью гидродинамики раздела физики,
изучающего движение жидкостей.
Согласно законам гидродинамики, количество жидкости (Q), протекающее
через любую трубу, прямо пропорционально разности давлений в начале (Р1)
и в конце (P2) трубы и обратно пропорционально сопротивлению (P2) току
жидкости:
Q=(P1-P2)/R
Если применить это уравнение к сосудистой системе, то следует иметь в виду,
что давление в конце данной системы, т. е. в месте впадения полых вен в сердце,
близко к нулю. В этом случае уравнение можно записать так:
Q=P/R
где Q — количество крови, изгнанное сердцем в минуту; Р —
величина среднего давления в аорте, R — величина сосудистого
сопротивления.
Из этого уравнения следует, что Р = Q*R, т. е. давление
(Р) в устье аорты прямо пропорционально объему крови, выбрасываемому
сердцем в артерии в минуту (Q) и величине периферического
сопротивления (R). Давление в аорте (P) и минутный
объем крови (Q) можно измерить непосредственно. Зная эти величины,
вычисляют периферическое сопротивление — важнейший показатель
состояния сосудистой системы.
Периферическое сопротивление сосудистой системы складывается из множества
отдельных сопротивлений каждого сосуда. Любой из таких сосудов можно уподобить
трубке, сопротивление которой (R) определяется по формуле
Пуазейля:
R=8lη/πr4
,
где l — длина трубки; η— вязкость протекающей в ней жидкости;
π— отношение окружности к диаметру; r— радиус трубки.
Сосудистая система состоит из множества отдельных трубок, соединенных
параллельно и последовательно. При последовательном соединении трубок их
суммарное сопротивление равно сумме сопротивлений каждой трубки:
R=R1+R2+R3+...+Rn
При параллельном соединении трубок их суммарное сопротивление вычисляют
по формуле:
R=1/(1/R1+1/R2+1/R3+...+1/Rn)
Точно определить сопротивление сосудов по этим формулам невозможно, так как
геометрия сосудов изменяется вследствие сокращения сосудистых мышц.
Вязкость крови также не является величиной постоянной. Например, если кровь
протекает через сосуды диаметром меньше 1 мм, вязкость крови значительно
уменьшается. Чем меньше диаметр сосуда, тем меньше вязкость протекающей в нем
крови. Это связано с тем, что в крови наряду с плазмой имеются форменные
элементы, которые располагаются в центре потока. Пристеночный слой
представляет собой плазму, вязкость которой намного меньше вязкости цельной
крови. Чем тоньше сосуд, тем большую часть площади его поперечного сечения
занимает слой с минимальной вязкостью, что уменьшает общую величину вязкости
крови. Теоретический расчет сопротивления капилляров невозможен, так как в
норме открыта только часть капиллярного русла, остальные капилляры являются
резервными и открываются по мере усиления обмена веществ в тканях.
Из приведенных уравнений видно, что наибольшей величиной сопротивления должен
обладать капилляр, диаметр которого 5— 7 мкм. Однако вследствие того что
огромное количество капилляров включено в сосудистую сеть, по которой
осуществляется ток крови, параллельно, их суммарное сопротивление меньше, чем
суммарное сопротивление артериол.
Основное сопротивление току крови возникает в артериолах. Систему артерий и
артериол называют сосудами сопротивления, или резистивными
сосудами.
Артериолы представляют собой тонкие сосуды (диаметром 15— 70 мкм). Стенка
этих сосудов содержит толстый слой циркулярно расположенных гладких мышечных
клеток, при сокращении которого просвет сосуда может значительно
уменьшаться. При этом резко повышается сопротивление артериол. Изменение
сопротивления артериол меняет уровень давления крови в артериях. В случае
увеличения сопротивления артериол отток крови из артерий уменьшается и
давление в них повышается. Падение тонуса артериол увеличивает отток крови из
артерий, что приводит к уменьшению артериального давления. Наибольшим
сопротивлением среди всех участков сосудистой системы обладают именно артериолы,
поэтому изменение их просвета является главным регулятором уровня общего
артериального давления. Артериолы — «краны сердечно-сосудистой системы» (И. М.
Сеченов). Открытие этих «кранов» увеличивает отток крови в капилляры
соответствующей области, улучшая местное кровообращение, а закрытие резко
ухудшает кровообращение данной сосудистой зоны.
Итак, артериолы играют двоякую роль: участвуют в поддержании необходимого
организму уровня общего артериального давления и в регуляции величины местного
кровотока через тот или иной орган или ткань. Величина органного кровотока
соответствует потребности органа в кислороде и питательных веществах,
определяемой уровнем рабочей активности органа.
В работающем органе тонус артериол уменьшается, что обеспечивает
повышение притока крови. Чтобы общее артериальное давление при этом не снизилось
в других (неработающих) органах, тонус артериол повышается. Суммарная величина
общего периферического сопротивления и общий уровень артериального давления
остаются примерно постоянными, несмотря на непрерывное перераспределение
крови между работающими и неработающими органами.
О сопротивлении в различных сосудах можно судить по разности давления крови в
начале и в конце сосуда: чем выше сопротивление току крови, тем большая сила
затрачивается на ее продвижение по сосуду и, следовательно, тем значительнее
падение давления на протяжении данного сосуда. Как показывают прямые измерения
давления крови в разных сосудах, давление на протяжении крупных и средних
артерий падает всего на 10%, а в артериолах и капиллярах — на 85%. Это
означает, что 10% энергии, затрачиваемой желудочками на изгнание крови,
расходуется на продвижение крови в крупных и средних артериях, а 85% — на
продвижение крови в артериолах и капиллярах. Распределение давления в разных
отделах сосудистого русла показано на рис. 7.17.
|
|
|
Рис. 7.17. Изменения давления в разных частях сосудистой
системы. I — в аорте; 2 — в крупных артериях; 3 — в мелких артериях; 4 — в
артериолах; 5 — в капиллярах; б — в венулах; 7 — в венах; 8 — в полой
вене. Штриховкой обозначено колебание давления в систолу и диастолу,
пунктиром — среднее давление.
|
Зная объемную скорость кровотока (количество крови, протекающее через
поперечное сечение сосуда), измеряемую в миллилитрах в секунду, можно рассчитать
линейную скорость кровотока, которая выражается в сантиметрах в секунду.
Линейная скорость (V) отражает скорость продвижения частиц крови вдоль
сосуда и равна объемной (Q), деленной на площадь сечения кровеносного
сосуда:
V=Q/πr2
Линейная скорость, вычисленная по этой формуле, есть средняя скорость. В
действительности линейная скорость различна для частиц крови, продвигающихся в
центре потока (вдоль продольной оси сосуда) и у сосудистой стенки. В центре
сосуда линейная скорость максимальна, около стенки сосуда она минимальна в связи
с тем, что здесь особенно велико трение частиц крови о стенку.
Объем крови, протекающей в 1 мин через аорту или полые вены и через легочную
артерию или легочные вены, одинаков. Отток крови от сердца соответствует ее
притоку. Из этого следует, что объем крови, протекший в 1 мин через всю
артериальную и всю венозную систему большого и малого круга кровообращения,
одинаков. При постоянном объеме крови, протекающей через любое общее
сечение сосудистой системы, линейная скорость кровотока не может быть
постоянной. Она зависит от общей ширины данного отдела сосудистого русла. Это
следует из уравнения, выражающего соотношение линейной и объемной скорости: чем
больше общая площадь сечения сосудов, тем меньше линейная скорость кровотока. В
кровеносной системе самым узким местом является аорта. При разветвлении артерий,
несмотря на то, что каждая ветвь сосуда уже той, от которой она произошла,
наблюдается увеличение суммарного русла, так как сумма просветов
артериальных ветвей больше просвета разветвившейся артерии. Наибольшее
расширение русла отмечается в капиллярной сети: сумма просветов всех капилляров
примерно в 500—600 раз больше просвета аорты. Соответственно этому кровь в
капиллярах движется в 500—600 раз медленнее, чем в аорте.
В венах линейная скорость кровотока снова возрастает, так как при слиянии вен
друг с другом суммарный просвет кровяного русла суживается. В полых венах
линейная скорость кровотока достигает половины скорости в аорте. Распределение
скорости кровотока в кровеносной системе показано на рис. 7.18.
|
|
|
Рис. 7.18. Средняя линейная скорость тока крови в разных
частях сосудистой системы.
|
В связи с тем что кровь выбрасывается сердцем отдельными порциями, кровоток в
артериях имеет пульсирующий характер, поэтому линейная и объемная скорости
непрерывно меняются: они максимальны в аорте и легочной артерии в момент систолы
желудочков и уменьшаются во время диастолы. В капиллярах и венах кровоток
постоянен, т. е. линейная скорость его постоянна. В превращении
пульсирующего кровотока в постоянный имеют значение свойства артериальной
стенки.
Непрерывный ток крови по всей сосудистой системе обусловливают
выраженные упругие свойства аорты и крупных артерий.
В сердечно-сосудистой системе часть кинетической энергии, развиваемой
сердцем во время систолы, затрачивается на растяжение аорты и отходящих от нее
крупных артерий. Последние образуют эластическую, или компрессионную, камеру, в
которую поступает значительный объем крови, растягивающий ее; при этом
кинетическая энергия, развитая сердцем, переходит в энергию эластического
напряжения артериальных стенок. Когда систола заканчивается, растянутые стенки
артерий стремятся спасаться и проталкивают кровь в капилляры, поддерживая
кровоток во время диастолы.
С позиций функциональной значимости для системы кровообращения сосуды
подразделяются на следующие группы:
1. Упруго-растяжимые — аорта с крупными артериями в большом круге
кровообращения, легочная артерия с ее ветвями — в малом круге, т. е. сосуды
эластического типа.
2. Сосуды сопротивления (резистивные сосуды) — артериолы, в том числе и
прекапиллярные сфинктеры, т. е. сосуды с хорошо выраженным мышечным слоем.
3. Обменные (капилляры) — сосуды, обеспечивающие обмен
газами и другими веществами между кровью и тканевой жидкостью.
4. Шунтирующие (артериовенозные анастомозы) — сосуды, обеспечивающие
«сброс» крови из артериальной в венозную систему сосудов, минуя капилляры.
5. Емкостные — вены, обладающие высокой
растяжимостью. Благодаря этому в венах содержится 75—80% крови.
Процессы, протекающие в последовательно соединенных сосудах, обеспечивающие
циркуляцию (кругооборот) крови, называют системной гемодинамикой.
Процессы, протекающие в параллельно подключенных к аорте и полым венам
сосудистых руслах, обеспечивая кровоснабжение органов, называют
регионарной, или органной, гемодинамикой.
7.2.2. Движение крови по сосудам
7.2.2.1. Артериальное давление
крови
Артериальное давление (АД) является одним из ведущих параметров гемодинамики.
Оно наиболее часто измеряется и служит предметом коррекции в клинике. Факторами,
определяющими величину АД, являются объемная скорость кровотока и величина
общего периферического сопротивления сосудов (ОПСС). Объемная скорость кровотока
для сосудистой системы большого круга кровообращения является минутным
объемом крови (МОК), нагнетаемым сердцем в аорту. В этом случае ОПСС служит
расчетной величиной, зависящей от тонуса сосудов мышечного типа (преимущественно
артериол), определяющего их радиус, длины сосуда и вязкости протекающей крови.
Методы определения МОК даны в разделе 7.1.2.2, а принципы расчета ОПСС — в
разделе 7.2.4.
Способы измерения давления. Давление в артериях у животного, а иногда
и у человека измеряют путем введения в артерию стеклянной канюли или катетера,
соединенного с манометром трубкой с жесткими стенками. Такой способ определения
давления называют прямыми (кровавым). Катетер и соединительную трубку
заполняют раствором противосвертывающего вещества, чтобы кровь в них не
свертывалась.
Давление крови в артериях не является постоянным: оно непрерывно
колеблется в пределах некоторого среднего уровня. На кривой артериального
давления эти колебания имеют различный вид.
Волны первого порядка (пульсовые) самые частые. Они
синхронизированы с сокращениями сердца. Во время каждой систолы порция
крови поступает в артерии и увеличивает их эластическое растяжение, при этом
давление в артериях повышается. Во время диастолы поступление крови из
желудочков в артериальную систему прекращается и происходит только отток крови
из крупных артерий: растяжение их стенок уменьшается и давление снижается.
Колебания давления, постепенно затухая, распространяются от аорты и
легочной артерии на все их разветвления. Наибольшая величина давления в
артериях (систолическое, или максимальное, давление)
наблюдается во время прохождения вершины пульсовой волны, а
наименьшая (диастолическое, или минимальное, давление) — во
время прохождения основания пульсовой волны. Разность между систолическим и
диастолическим давлением, т. е. амплитуда колебаний давления, называется
пульсовым давлением. Оно создает волну первого порядка. Пульсовое
давление при прочих равных условиях пропорционально количеству крови,
выбрасываемой сердцем при каждой систоле.
В мелких артериях пульсовое давление снижается и, следовательно, разница
между систолическим и диастолическим давлением уменьшается. В артериолах и
капиллярах пульсовые волны артериального давления отсутствуют.
Кроме систолического, диастолического и пульсового артериального
давления определяют так называемое среднее артериальное давление. Оно
представляет собой ту среднюю величину давления, при которой в отсутствие
пульсовых колебаний наблюдается такой же гемодинамический эффект, как и при
естественном пульсирующим давлении крови, т. е. среднее артериальное
давление — это равнодействующая всех изменений давления в сосудах.
Продолжительность понижения диастолического давления больше, чем
повышения систолического, поэтому среднее давление ближе к величине
диастолического давления. Среднее давление в одной и той же артерии представляет
собой более постоянную величину, а систолическое и диастолическое изменчивы.
Кроме пульсовых колебаний, на кривой АД наблюдаются волны второго порядка,
совпадающие с дыхательными движениями: поэтому их называют
дыхательными волнами: у человека вдох сопровождается понижением АД,
а выдох — повышением.
В некоторых случаях на кривой АД отмечаются волны третьего порядка.
Это еще более медленные повышения и понижения давления, каждое из
которых охватывает несколько дыхательных волн второго порядка. Указанные волны
обусловлены периодическими изменениями тонуса сосудодвигательных центров. Они
наблюдаются чаще всего при недостаточном снабжении мозга кислородом,
например при подъеме на высоту, после кровопотери или отравлениях
некоторыми ядами.
Кроме прямого, применяют косвенные, или бескровные, способы определения
давления. Они основываются на измерении давления, которому нужно подвергнуть
стенку данного сосуда извне, чтобы прекратить по нему ток крови. Для такого
исследования применяют сфигмоманометр Рива-Роччи. Обследуемому
накладывают на плечо полую резиновую манжету, которая соединена с резиновой
грушей, служащей для нагнетания воздуха, и с манометром. При надувании
манжета сдавливает плечо, а манометр показывает величину этого давления. Для
измерения давления крови с помощью этого прибора, по предложению Н. С.
Короткова, выслушивают сосудистые тоны, возникающие в артерии к периферии
от наложенной на плечо манжеты.
При движении крови в несдавленной артерии звуки отсутствуют. Если давление в
манжете поднять выше уровня систолического АД, то манжета полностью сдавливает
просвет артерии и кровоток в ней прекращается. Звуки при этом также отсутствуют.
Если теперь постепенно выпускать воздух из манжеты (т. е. проводить
декомпрессию), то в момент, когда давление в ней станет чуть ниже уровня
систолического АД, кровь при систоле преодолевает сдавленный участок и
прорывается за манжету. Удар о стенку артерии порции крови, движущейся через
сдавленный участок с большой скоростью и кинетической энергией, порождает звук,
слышимый ниже манжеты. Давление в манжете, при котором появляются первые
звуки в артерии, возникает в момент прохождения вершины пульсовой волны и
соответствует максимальному, т. е. систолическому, давлению. При дальнейшем
снижении давления в манжете наступает момент, когда оно становится ниже
диастолического, кровь начинает проходить по артерии как во время вершины, так и
основания пульсовой волны. В этот момент звуки в артерии ниже манжеты исчезают.
Давление в манжете в момент исчезновения звуков в артерии соответствует величине
минимального, т. е. диастолического, давления. Величины давления в артерии,
определенные по способу Короткова и зарегистрированные у этого же человека
путем введения в артерию катетера, соединенного с электроманометром,
существенно не отличаются друг от друга.
У взрослого человека среднего возраста систолическое давление в аорте при
прямых измерениях равно 110—125 мм рт.ст. Значительное снижение давления
происходит в мелких артериях, в артериолах. Здесь давление резко уменьшается,
становясь на артериальном конце капилляра равным 20—30 мм рт.ст.
В клинической практике АД определяют обычно в плечевой артерии. У здоровых
людей в возрасте 15—50 лет максимальное давление, измеренное способом Короткова,
составляет 110—125 мм рт.ст. В возрасте старше 50 лет оно, как правило,
повышается. У 60-летних максимальное давление равно в среднем 135—140 мм рт.ст.
У новорожденных максимальное артериальное давление 50 мм рт.ст., но уже через
несколько дней становится 70 мм рт.ст. и к концу 1-го месяца жизни — 80 мм
рт.ст.
Минимальное артериальное давление у взрослых людей среднего возраста в
плечевой артерии в среднем равно 60—80 мм рт.ст., пульсовое составляет 35—50 мм
рт.ст., а среднее — 90—95 мм рт.ст.
7.2.2.2. Артериальный пульс
Артериальным пульсом называют ритмические колебания стенки артерии,
обусловленные повышением давления в период систолы. Пульсацию артерий можно
легко обнаружить прикосновением к любой доступной ощупыванию артерии: лучевой
(a. radialis), височной (a. temporalis), наружной артерии стопы (a.
dorsalis pedis) и др.
Пульсовая волна, или колебательное изменения диаметра или объема артериальных
сосудов, обусловлена волной повышения давления, возникающей в аорте в
момент изгнания крови из желудочков. В это время давление в аорте резко
повышается и стенка ее растягивается. Волна повышенного давления и вызванные
этим растяжением колебания сосудистой стенки с определенной скоростью
распространяются от аорты до артериол и капилляров, где пульсовая волна
гаснет.
Скорость распространения пульсовой волны не зависит от скорости движения
крови. Максимальная линейная скорость течения крови по артериям не превышает
0,3—0,5 м/с, а скорость распространений пульсовой волны у людей молодого и
среднего возраста при нормальном артериальном давлении и нормальной
эластичности сосудов равна в аорте 5,5—8,0 м/с, а в периферических
артериях — 6,0—9,5 м/с. С возрастом по мере понижения эластичности сосудов
скорость распространения пульсовой волны, особенно в аорте,
увеличивается.
Для детального анализа отдельного пульсового колебания производят его
графическую регистрацию при помощи специальных приборов — сфигмографов. В
настоящее время для исследования пульса используют датчики, преобразующие
механические колебания сосудистой стенки в электрические изменения, которые
и регистрируют.
В пульсовой кривой (сфигмограмме) аорты и крупных артерий различают две
основные части — подъем и спад. Подъем кривой — анакрота — возникает
вследствие повышения АД и вызванного этим растяжения, которому подвергаются
стенки артерий под влиянием крови, выброшенной из сердца в начале фазы
изгнания. В конце систолы желудочка, когда давление в нем начинает падать,
происходит спад пульсовой кривой — катакрота. В тот момент, когда
желудочек начинает расслабляться и давление в его полости становится ниже, чем в
аорте, кровь, выброшенная в артериальную систему, устремляется назад к
желудочку; давление в артериях резко падает и на пульсовой кривой крупных
артерий появляется глубокая выемка — инцизура. Движение крови обратно к
сердцу встречает препятствие, так как полулунные клапаны под влиянием обратного
тока крови закрываются и препятствуют поступлению ее в сердце. Волна крови
отражается от клапанов и создает вторичную волну повышения давления, вызывающую
вновь растяжение артериальных стенок. В результате на сфигмограмме появляется
вторичный, или дикротический, подъем. Формы кривой пульса аорты и
отходящих непосредственно от нее крупных сосудов, так называемого центрального
пульса, и кривой пульса периферических артерий несколько отличаются (рис.
7.19).
|
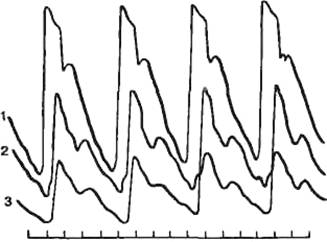
|
|
Рис. 7.19. Сфигмограммы сонной (1), лучевой (2) и пальцевой
(3) артерий, записанные синхронно.
|
Исследование пульса, как пальпаторное, так и инструментальное, посредством
регистрации сфигмограммы дает ценную информацию о функционировании
сердечно-сосудистой системы. Это исследование позволяет оценить как сам факт
наличия биений сердца, так и частоту его сокращений, ритм (ритмичный или
аритмичный пульс). Колебания ритма могут иметь и физиологический характер. Так,
«дыхательная аритмия», проявляющаяся в увеличении частоты пульса на вдохе и
уменьшении при выдохе, обычно выражена у молодых людей. Напряжение (твердый или
мягкий пульс) определяют по величине усилия, которое необходимо приложить для
того, чтобы пульс в дистальном участке артерии исчез. Напряжение пульса в
определенной мере отображает величину среднего АД.
7.2.2.3. Объемная скорость
кровотока
Как уже указывалось, различают линейную и объемную скорость тока крови,
которая зависит от развития сосудистой сети в данном органе и от интенсивности
его деятельности.
При работе органов в них происходит расширение сосудов и, следовательно,
уменьшается сопротивление. Объемная скорость тока крови в сосудах работающего
органа увеличивается.
Для измерения объемной и линейной скорости кровотока в сосудах
предложено несколько методов. Один из современных методов —
ультразвуковой: к артерии на небольшом расстоянии друг от друга
прикладывают две маленькие пьезоэлектрические пластинки, которые способны
преобразовывать механические колебания в электрические и обратно. На первую
пластинку подают электрическое напряжение высокой частоты. Оно
преобразуется в ультразвуковые колебания, которые передаются с кровью на
вторую пластинку, воспринимаются ею и преобразуются в высокочастотные
электрические колебания. Определив, как быстро распространяются
ультразвуковые колебания по току крови от первой пластинки ко второй и в
обратном направлении, т. е. против тока крови, можно рассчитать скорость
кровотока. Чем быстрее ток крови, тем быстрее будут распространяться
ультразвуковые колебания в одном направлении и медленнее — в
противоположном.
Достаточно широкое распространение получил метод электромагнитной
флоурометрии. Он основан на принципе электромагнитной индукции. Сосуд
располагают между полюсами подковообразного магнита. Кровь, являясь
проводящей средой, двигаясь вдоль сосуда, пересекает магнитное поле и создает
ЭДС, которая направлена перпендикулярно магнитному полю и движению крови.
Величина ЭДС пропорциональна напряженности поля и скорости движения в
нем крови. Воспринимает ЭДС датчик, выполненный в виде незамкнутого кольца,
надеваемого на сосуд. Измеряя ЭДС, определяют скорость движения крови.
Объемную скорость кровотока у человека в конечности возможно определить
посредством плетизмографии. Методика состоит в регистрации изменений
объема органа или части тела, зависящих от их кровенаполнения, т. е. от разности
между притоком крови по артериям и оттоком ее по венам. При плетизмографии
конечность или ее часть заключают в жесткий герметический сосуд,
соединенный с манометром для измерения малых колебаний давления. В
случае изменения кровенаполнения конечности изменяется ее объем, что
вызывает увеличение или уменьшение давления в сосуде, в который помещена
конечность; давление регистрируется манометром и записывается в виде кривой —
плетизмограммы. Для определения объемной скорости кровотока в конечности на
несколько секунд сжимают вены и прерывают венозный отток. Поскольку приток крови
по артериям продолжается, а венозного оттока нет, увеличение объема конечности
соответствует количеству притекающей крови. Такая методика получила название
окклюзионной (окклюзия — закупорка, зажатие) плетизмографии.
Величина кровотока в разных органах представлена в табл. 7.1.
Таблица 7.1. Величина кровотока в органах (на 100 г массы)
|
Орган |
Кровоток, мл/мин |
|
Щитовидная железа |
560 |
|
Почки |
420 |
|
Печень |
150 |
|
Сердце (коронарные сосуды) |
85 |
|
Кишечник |
50 |
|
Мозг |
65 |
|
Селезенка |
70 |
|
Желудок |
35 |
|
Мышцы рук и ног (в покое) |
2—3 |
7.2.2.4. Движение крови в
капиллярах. Микроциркуляция
Капилляры представляют собой тончайшие сосуды, диаметром 5—7 мкм, длиной
0,5—1,1 мм. Эти сосуды пролегают в межклеточных пространствах, тесно
соприкасаясь с клетками органов и тканей организма. Суммарная длина всех
капилляров тела человека составляет около 100 000 км, т. е. нить, которой
можно было бы 3 раза опоясать земной шар по экватору. Физиологическое значение
капилляров состоит в том, что через их стенки осуществляется обмен веществ
между кровью и тканями. Стенки капилляров образованы только одним слоем клеток
эндотелия, снаружи которого находится тонкая соединительнотканная базальная
мембрана.
Скорость кровотока в капиллярах невелика и составляет 0,5— 1 мм/с. Таким
образом, каждая частица крови находится в капилляре примерно 1 с. Небольшая
толщина слоя крови (7—8 мкм) и тесный контакт его с клетками органов и тканей, а
также непрерывная смена крови в капиллярах обеспечивают возможность обмена
веществ между кровью и тканевой (межклеточной) жидкостью.
В тканях, отличающихся интенсивным обменом веществ, число капилляров на 1
мм2 поперечного сечения больше, чем в тканях, в которых обмен веществ
менее интенсивный. Так, в сердце на 1 мм2 сечения в 2 раза больше
капилляров, чем в скелетной мышце. В сером веществе мозга, где много клеточных
элементов, капиллярная сеть значительно более густая, чем в белом.
Различают два вида функционирующих капилляров. Одни из них образуют
кратчайший путь между артериолами и венулами (магистральные капилляры).
Другие представляют собой боковые ответвления от первых: они отходят от
артериального конца магистральных капилляров и впадают в их венозный конец.
Эти боковые ответвления образуют капиллярные сети. Объемная и линейная
скорость кровотока в магистральных капиллярах больше, чем в боковых
ответвлениях. Магистральные капилляры играют важную роль в распределении крови в
капиллярных сетях и в других феноменах микроциркуляции.
Давление крови в капиллярах измеряют прямым способом: под контролем
бинокулярного микроскопа в капилляр вводят тончайшую канюлю, соединенную с
электроманометром. У человека давление на артериальном конце капилляра равно 32
мм рт.ст., а на венозном — 15 мм рт.ст., на вершине петли капилляра ногтевого
ложа — 24 мм рт.ст. В капиллярах почечных клубочков давление достигает 65— 70 мм
рт.ст., а в капиллярах, оплетающих почечные канальцы, — всего 14—18 мм рт.ст.
Очень невелико давление в капиллярах легких — в среднем 6 мм рт.ст.
Измерение капиллярного давления производят в положении тела, при котором
капилляры исследуемой области находятся на одном уровне с сердцем. В случае
расширения артериол давление в капиллярах повышается, а при сужении
понижается.
Кровь течет лишь в «дежурных» капиллярах. Часть капилляров выключена из
кровообращения. В период интенсивной деятельности органов (например, при
сокращении мышц или секреторной активности желез), когда обмен веществ в них
усиливается, количество функционирующих капилляров значительно возрастает.
Регулирование капиллярного кровообращения нервной системой, влияние на него
физиологически активных веществ — гормонов и метаболитов — осуществляются
при воздействии их на артерии и артериолы. Сужение или расширение артерий и
артериол изменяет как количество функционирующих капилляров, распределение крови
в ветвящейся капиллярной сети, так и состав крови, протекающей по капиллярам, т.
е. соотношение эритроцитов и плазмы. При этом общий кровоток через
метартериолы и капилляры определяется сокращением гладких мышечных клеток
артериол, а степень сокращения прекапиллярных сфинктеров (гладких мышечных
клеток, расположенных у устья капилляра при его отхождении от метаартериол)
определяет, какая часть крови пройдет через истинные капилляры.
В некоторых участках тела, например в коже, легких и почках, имеются
непосредственные соединения артериол и венул — артериовенозные анастомозы.
Это наиболее короткий путь между артериолами и венулами. В обычных условиях
анастомозы закрыты и кровь проходит через капиллярную сеть. Если анастомозы
открываются, то часть крови может поступать в вены, минуя капилляры.
Артериовенозные анастомозы играют роль шунтов, регулирующих капиллярное
кровообращение. Примером этого является изменение капиллярного
кровообращения в коже при повышении (свыше 35°С) или понижении (ниже 15°С)
температуры окружающей среды. Анастомозы в коже открываются и устанавливается
ток крови из артериол непосредственно в вены, что играет большую роль в
процессах терморегуляции.
Структурной и функциональной единицей кровотока в мелких сосудах
является сосудистый модуль — относительно обособленный в гемодинамическом
отношении комплекс микрососудов, снабжающий кровью определенную клеточную
популяцию органа. При этом имеет место специфичность васкуляризации тканей
различных органов, что проявляется в особенностях ветвления микрососудов,
плотности капилляризации тканей и др. Наличие модулей позволяет регулировать
локальный кровоток в отдельных микроучастках тканей.
Микроциркуляция — собирательное понятие. Оно объединяет механизмы
кровотока в мелких сосудах и теснейшим образом связанный с кровотоком обмен
жидкостью и растворенными в ней газами и веществами между сосудами и тканевой
жидкостью.
Специального рассмотрения заслуживают процессы обмена между кровью и тканевой
жидкостью. Через сосудистую систему за сутки проходит 8000—9000 л крови. Через
стенку капилляров профильтровывается около 20 л жидкости и 18 л
реабсорбируется в кровь. По лимфатическим сосудам оттекает около 2 л жидкости.
Закономерности, обусловливающие обмен жидкости между капиллярами и
тканевыми пространствами, были описаны Стерлингом. Гидростатическое
давление крови в капиллярах (Ргк) является основной силой, направленной на
перемещение жидкости из капилляров в ткани. Основной силой, удерживающей
жидкость в капиллярном русле, является онкотическое давление плазмы в капилляре
(Рок). Определенную роль играют также гидростатическое давление (Ргт) и
онкотическое давление тканевой жидкости (Рот) (рис. 7.20).
|
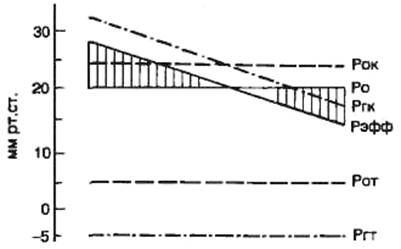
|
|
Рис. 7.20. Обмен водой между капилляром и межклеточным
пространством (схема). Объяснения в тексте.
|
На артериальном конце капилляра Ргк составляет 30—35 мм рт.ст., а на венозном
— 15—20 мм рт.ст. Рок на всем протяжении остается относительно постоянным и
составляет 25 мм рт.ст. Таким образом, на артериальном конце капилляра
осуществляется процесс фильтрации — выхода жидкости, а на венозном — обратный
процесс — реабсорбция жидкости. Определенные коррективы вносит в этот
процесс Рот, равное примерно 4,5 мм рт.ст., которое удерживает жидкость в
тканевых пространствах, а также отрицательная величина Ргт (-3—9 мм
рт.ст.).
Следовательно, объем жидкости, переходящей через стенку капилляра за
одну минуту (V), при коэффициенте фильтрации К равен:
V=(Ргк + Рот + Ргт - Рок)*К.
На артериальном конце капилляра V положителен, здесь происходит
фильтрация жидкости в ткань, а на венозном — V отрицателен и жидкость
реабсорбируется в кровь. Транспорт электролитов и низкомолекулярных
веществ, например глюкозы, осуществляется вместе с водой.
Капилляры различных органов отличаются по своей ультраструктуре, а
следовательно, по способности пропускать в тканевую жидкость белки. Так, 1
л лимфы в печени содержит 60 г белка, в миокарде — 30 г, в мышцах — 20 г и в
коже — 10 г. Белок, проникший в тканевую жидкость, с лимфой возвращается в
кровь.
Механизмы транспорта газов в тканях описаны в главе 8.
7.2.2.5. Движение крови в венах
Движение крови в венах обеспечивает наполнение полостей сердца во время
диастолы. Ввиду небольшой толщины мышечного слоя стенки вен гораздо более
растяжимы, чем стенки артерий, поэтому в венах может скапливаться большое
количество крови. Даже если давление в венозной системе повысится всего на
несколько миллиметров, объем крови в венах увеличится в 2—3 раза, а при
повышении давления в венах на 10 мм рт.ст. вместимость венозной системы
возрастет в 6 раз. Вместимость вен может также изменяться при сокращении или
расслаблении гладкой мускулатуры венозной стенки. Таким образом, вены (а также
сосуды малого круга кровообращения) являются резервуаром крови переменной
емкости.
Венозное давление. Давление в венах у человека можно измерить,
вводя в поверхностную (обычно локтевую) вену полую иглу и соединяя ее с
чувствительным электроманометром. В венах, находящихся вне грудной полости,
давление равно 5—9 мм рт.ст.
Для определения венозного давления необходимо, чтобы данная вена
располагалась на уровне сердца. Это важно потому, что к величине кровяного
давления, например в венах ног в положении стоя, присоединяется гидростатическое
давление столба крови, наполняющего вены.
В венах грудной полости, а также в яремных венах давление близко к
атмосферному и колеблется в зависимости от фазы дыхания. При вдохе, когда
грудная клетка расширяется, давление понижается и становится отрицательным, т.
е. ниже атмосферного. При выдохе происходят противоположные изменения и давление
повышается (при обычном выдохе оно не поднимается выше 2—5 мм рт.ст.). Ранение
вен, лежащих вблизи грудной полости (например, яремных вен), опасно, так как
давление в них в момент вдоха является отрицательным. При вдохе возможно
поступление атмосферного воздуха в полость вен и развитие воздушной эмболии, т.
е. перенос пузырьков воздуха кровью и последующая закупорка ими артериол и
капилляров, что может привести к смерти.
Скорость кровотока в венах. Кровяное русло в венозной части шире, чем
в артериальной, что по законам гемодинамики должно привести к замедлению тока
крови. Скорость тока крови в периферических венах среднего калибра 6—14
см/с, в полых венах достигает 20 см/с.
Движение крови в венах происходит прежде всего вследствие разности давления
крови в мелких и крупных венах (градиент давления), т. е. в начале и конце
венозной системы. Эта разность, однако, невелика, и потому кровоток в венах
определяется рядом добавочных факторов. Одним из них является то, что эндотелий
вей (за исключением полых вен, вен воротной системы и мелких венул) образует
клапаны, пропускающие кровь только по направлению к сердцу. Скелетные
мышцы, сокращаясь, сдавливают вены, что вызывает передвижение крови; обратно
кровь не идет вследствие наличия клапанов. Этот механизм перемещения крови в
венах называют мышечным насосом.
Таким образом, силами, обеспечивающими перемещение крови по венам, являются
градиент давления между мелкими и крупными венами, сокращение скелетных мышц
(«мышечный насос»), присасывающее действие грудной клетки.
Венный пульс. В мелких и средних венах пульсовые колебания давления
крови отсутствуют. В крупных венах вблизи сердца отмечаются пульсовые
колебания — венный пульс, имеющий иное происхождение, чем артериальный пульс. Он
обусловлен затруднением притока крови из вен в сердце во время систолы
предсердий и желудочков. Во время систолы этих отделов сердца давление внутри
вен повышается и происходят колебания их стенок. Удобнее всего записывать венный
пульс яремной вены.
На кривой венного пульса — флебограмме — различают три зубца: а, с,
v (рис. 7.21). Зубец а совпадает с систолой правого предсердия
и обусловлен тем, что в момент систолы предсердия устья полых вей зажимаются
кольцом мышечных волокон, вследствие чего приток крови из вен в предсердия
временно приостанавливается. Во время диастолы предсердий доступ в них
крови становится вновь свободным, и в это время кривая венного пульса круто
падает. Вскоре на кривой венного пульса появляется небольшой зубец
c. Он обусловлен толчком пульсирующей сонной артерии, лежащей вблизи
яремной вены. После зубца c начинается падение кривой, которое сменяется
новым подъемом — зубцом v. Последний обусловлен тем, что к концу систолы
желудочков предсердия наполнены кровью, дальнейшее поступление в них крови
невозможно, происходят застой крови в венах и растяжение их стенок. После зубца
v наблюдается падение кривой, совпадающее с диастолой желудочков и
поступлением в них крови из предсердий.
|

|
|
Рис. 7.21. Флебограмма. Объяснения в тексте.
|
7.2.2.6. Время кругооборота
крови
Время полного кругооборота крови — это время, необходимое для того, чтобы она
прошла через большой и малый круг кровообращения.
Для измерения времени полного кругооборота крови применяют ряд способов,
принцип которых заключается в том, что в вену вводят какое-либо вещество, не
встречающееся обычно в организме, и определяют, через какой промежуток времени
оно появляется в одноименной вене другой стороны.
В последние годы скорость кругооборота (или только в малом, или только в
большом круге) определяют при помощи радиоактивного изотопа натрия и
счетчика электронов. Для этого несколько таких счетчиков помещают на разных
частях тела вблизи крупных сосудов и в области сердца. После введения в локтевую
вену радиоактивного изотопа натрия определяют время появления
радиоактивного излучения в области сердца и исследуемых сосудов.
Время полного кругооборота крови у человека составляет в среднем 27
систол сердца. При частоте сердечных сокращений 70—80 в минуту кругооборот крови
происходит приблизительно за 20—23 с, однако скорость движения крови по оси
сосуда больше, чем у его стенок. Поэтому не вся кровь совершает полный
кругооборот так быстро и указанное время является минимальным.
Исследования на собаках показали, что 1/5 времени
полного кругооборота крови приходится на прохождение крови по малому кругу
кровообращения и 4/5 — по большому.
7.2.3. Регуляция движения крови по
сосудам
Каждая клетка, ткань и орган нуждаются в кислороде и питательных
веществах в количестве, соответствующем их метаболизму, т. е. интенсивности их
функции. В связи с этим тканям необходимо поступление строго определенного
количества крови, несущей О2 и питательные вещества, в единицу
времени. Эта потребность обеспечивается благодаря поддержанию постоянного
уровня АД и одновременно непрерывного перераспределения протекающей крови
между всеми органами и тканями в соответствии с их потребностями в каждый данный
момент.
Механизмы, регулирующие кровообращение, можно подразделить на две
категории: 1) центральные, определяющие величину АД и системное кровообращение,
и 2) местные, контролирующие величину кровотока через отдельные органы и ткани.
Хотя такое разделение является удобным, оно в значительной мере условно, так как
процессы местной регуляции осуществляются с участием центральных механизмов, а
управление системным кровообращением зависит от деятельности местных
регуляторных механизмов.
Постоянство АД сохраняется благодаря непрерывному поддержанию точного
соответствия между величиной сердечного выброса и величиной общего
периферического сопротивления сосудистой системы, которое зависит от тонуса
сосудов.
Гладкие мышцы сосудов постоянно, даже после устранения всех внешних нервных и
гуморальных регуляторных влияний на сосуды, находятся на исходном уровне
сокращения. Это так называемый базальный тонус. Возникновение его
обусловлено тем, что в некоторых участках гладкой мускулатуры сосудистой
стенки имеются очаги автоматии, генерирующие ритмические импульсы.
Распространение этих импульсов на остальные гладкие мышечные клетки
вызывает их возбуждение и создает базальный тонус. Кроме того, гладкие мышцы
сосудистых стенок находятся под влиянием постоянной тонической
импульсации, поступающей по волокнам симпатических нервов.
Симпатические влияния формируются в сосудо-двигательном центре и поддерживают
определенную степень сокращения гладкой мускулатуры сосудов.
7.2.3.1. Иннервация сосудов
Сужение артерий и артериол, снабженных преимущественно симпатическими
нервами (вазоконстрикция) было впервые обнаружено Вальтером (1842) в
опытах на лягушках, а затем Бернаром (1852) в экспериментах на ухе кролика.
Классический опыт Бернара состоит в том, что перерезка симпатического нерва на
одной стороне шеи у кролика вызывает расширение сосудов, проявляющееся
покраснением и потеплением уха оперированной стороны. Если раздражать
симпатический нерв на шее, то ухо на стороне раздражаемого нерва бледнеет
вследствие сужения его артерий и артериол, а температура понижается.
Главными сосудосуживающими нервами органов брюшной полости являются
симпатические волокна, проходящие в составе внутренностного нерва (п.
splanchnicus). После перерезки этих нервов кровоток через сосуды брюшной
полости, лишенной сосудосуживающей симпатической иннервации, резко
увеличивается вследствие расширения артерий и артериол. При раздражении п.
splanchnicus сосуды желудка и тонкой кишки суживаются.
Симпатические сосудосуживающие нервы к конечностям идут в составе
спинномозговых смешанных нервов, а также по стенкам артерий (в их
адвентициальной оболочке). Поскольку перерезка симпатических нервов вызывает
расширение сосудов той области, которая иннервируется этими нервами, считают,
что артерии и артериолы находятся под непрерывным сосудосуживающим влиянием
симпатических нервов.
Чтобы восстановить нормальный уровень артериального тонуса после перерезки
симпатических нервов, достаточно раздражать их периферические отрезки
электрическими стимулами частотой 1—2 в секунду. Увеличение частоты стимуляции
может вызвать сужение артериальных сосудов.
Сосудорасширяющие эффекты (вазодилатация) впервые обнаружили при
раздражении нескольких нервных веточек, относящихся к парасимпатическому отделу
нервной системы. Например, раздражение барабанной струны (chorda timpani)
вызывает расширение сосудов подчелюстной железы и языка, п. cavernosi penis —
расширение сосудов пещеристых тел полового члена.
В некоторых органах, например в скелетной мускулатуре, расширение
артерий и артериол происходит при раздражении симпатических нервов, в
составе которых имеются, кроме вазоконстрикторов, и вазодилататоры. При этом
активация α-адренорецепторов приводит к сжатию (констрикции) сосудов.
Активация β-адренорецепторов, наоборот, вызывает вазодилатацию. Следует
заметить, что β-адренорецепторы обнаружены не во всех органах.
Расширение сосудов (главным образом кожи) можно вызвать также раздражением
периферических отрезков задних корешков спинного мозга, в составе которых
проходят афферентные (чувствительные) волокна.
Эти факты, обнаруженные в 70-х годах прошлого столетия, вызвали среди
физиологов много споров. Согласно теории Бейлиса и Л. А. Орбели, одни и те же
заднекорешковые волокна передают импульсы в обоих направлениях: одна веточка
каждого волокна идет к рецептору, а другая — к кровеносному сосуду. Рецепторные
нейроны, тела которых находятся в спинномозговых узлах, обладают двоякой
функцией: передают афферентные импульсы в спинной мозг и эфферентные импульсы к
сосудам. Передача импульсов в двух направлениях возможна потому, что афферентные
волокна, как и все остальные нервные волокна, обладают двусторонней
проводимостью.
Согласно другой точке зрения, расширение сосудов кожи при раздражении
задних корешков происходит вследствие того, что в рецепторных нервных окончаниях
образуются ацетилхолин и гистамин, которые диффундируют по тканям и
расширяют близлежащие сосуды.
7.2.3.2.
Сосудодвигательный центр
В. Ф. Овсянниковым (1871) было установлено, что нервный центр, обеспечивающий
определенную степень сужения артериального русла — сосудодвигательный центр —
находится в продолговатом мозге. Локализация этого центра определена путем
перерезки ствола мозга на разных уровнях. Если перерезка произведена у собаки
или кошки выше четверохолмия, то АД не изменяется. Если перерезать мозг
между продолговатым и спинным мозгом, то максимальное давление крови в сонной
артерии понижается до 60—70 мм рт.ст. Отсюда следует, что
сосудодвигательный центр локализован в продолговатом мозге и находится в
состоянии тонической активности, т. е. длительного постоянного возбуждения.
Устранение его влияния вызывает расширение сосудов и падение АД.
Более детальный анализ показал, что сосудодвигательный центр продолговатого
мозга расположен на дне IV желудочка и состоит из двух отделов — прессорного и
депрессорного. Раздражение прессорного отдела сосудодвигательного центра
вызывает сужение артерий и подъем, а раздражение второго — расширение артерий и
падение АД.
Считают, что депрессорный отдел сосудодвигательного центра вызывает
расширение сосудов, понижая тонус прессорного отдела и снижая, таким образом,
эффект сосудосуживающих нервов.
Влияния, идущие от сосудосуживающего центра продолговатого мозга, приходят к
нервным центрам симпатической части вегетативной нервной системы,
расположенным в боковых рогах грудных сегментов спинного мозга, регулирующих
тонус сосудов отдельных участков тела. Спинномозговые центры способны через
некоторое время после выключения сосудосуживающего центра продолговатого мозга
немного повысить давление крови, снизившееся вследствие расширения артерий и
артериол.
Кроме сосудодвигательных центров продолговатого и спинного мозга, на
состояние сосудов оказывают влияние нервные центры промежуточного мозга и
больших полушарий.
7.2.3.3. Рефлекторная
регуляция сосудистого тонуса
Как отмечалось, артерии и артериолы постоянно находятся в состоянии сужения,
в значительной мере определяемого тонической активностью сосудодвигательного
центра. Тонус сосудодвигательного центра зависит от афферентных сигналов,
приходящих от периферических рецепторов, расположенных в некоторых
сосудистых областях и на поверхности тела, а также от влияния гуморальных
раздражителей, действующих непосредственно на нервный центр. Следовательно,
тонус сосудодвигательного центра имеет как рефлекторное, так и гуморальное
происхождение.
По классификации В. Н. Черниговского, рефлекторные изменения тонуса
артерий — сосудистые рефлексы — могут быть разделены на две группы: собственные
и сопряженные рефлексы.
Собственные сосудистые рефлексы. Вызываются сигналами от
рецепторов самих сосудов. Особенно важное физиологическое значение имеют
рецепторы, сосредоточенные в дуге аорты и в области разветвления сонной артерии
на внутреннюю и наружную. Указанные участки сосудистой системы получили
название сосудистых рефлексогенных зон.
Рецепторы, расположенные в дуге аорты, являются окончаниями
центростремительных волокон, проходящих в составе аортального нерва. Ционом и
Людвигом этот нерв функционально был обозначен как депрессор.
Электрическое раздражение центрального конца нерва обусловливает
падение АД вследствие рефлекторного повышения тонуса ядер блуждающих нервов и
рефлекторного снижения тонуса сосудосуживающего центра. В результате сердечная
деятельность тормозится, а сосуды внутренних органов расширяются. Если у
подопытного животного, например у кролика, перерезаны блуждающие нервы, то
раздражение аортального нерва вызывает только рефлекторное расширение сосудов
без замедления сердечного ритма.
В рефлексогенной зоне сонного синуса (каротидный синус, sinus caroticus)
расположены рецепторы, от которых идут центростремительные нервные волокна,
образующие синокаротидный нерв, или нерв Геринга. Этот нерв вступает в мозг в
составе языкоглоточного нерва. При введении в изолированный каротидный синус
крови через канюлю под давлением можно наблюдать падение АД в сосудах тела (рис.
7.22). Понижение системного АД обусловлено тем, что растяжение стенки сонной
артерии возбуждает рецепторы каротидного синуса, рефлекторно понижает тонус
сосудосуживающего центра и повышает тонус ядер блуждающих нервов.
Рецепторы сосудистых рефлексогенных зон возбуждаются при повышении давления
крови в сосудах, поэтому их называют прессорецепторами, или
барорецепторами. Если перерезать синокаротидные и аортальные нервы с
обеих сторон, возникает гипертензия, т. е. устойчивое повышение АД, достигающее
в сонной артерии собаки 200—250 мм рт.ст. вместо 100—120 мм рт.ст. в норме.
|
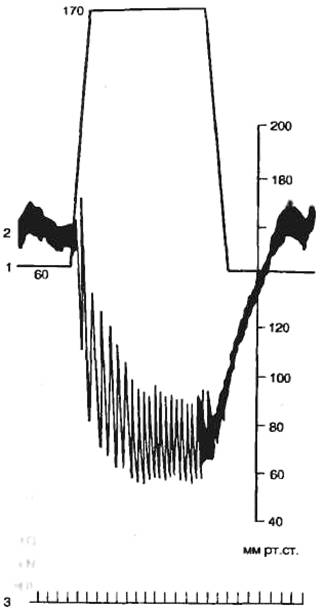
|
|
Рис. 7.22. Влияние повышения давления в изолированном каротидном
(сонном) синусе (методика Е. М. Моисеева) на артериальное давление
собаки (по Геймансу).
1 — давление в каротидном синусе; 2 — артериальное давление; 3 —
отметка времени 3 с. Цифрами справа обозначены величины артериального
давления, слева — величины давления в каротидном
синусе.
|
Понижение АД вследствие, например, уменьшения объема крови в организме (при
кровопотерях), ослабления деятельности сердца или при перераспределении крови и
оттоке ее в избыточно расширившиеся кровеносные сосуды какого-нибудь
крупного органа ведет к тому, что прессорецепторы дуги аорты и сонных артерий
раздражаются менее интенсивно, чем при нормальном АД. Влияние
аортальных и синокаротидных нервов на нейроны сердечно-сосудистого центра
ослабляется, сосуды суживаются, работа сердца усиливается и АД нормализуется.
Этот способ регуляции АД представляет собой регуляцию «на выходе»
системы, работающую по принципу отрицательной обратной связи. При отклонении
АД от заданной величины включаются компенсаторные реакции,
восстанавливающие это давление до нормы. Это — регуляция «по
рассогласованию».
Существует еще один, принципиально иной, механизм регуляции АД «на выходе»
системы, «по возмущению». В данном случае компенсаторные реакции
включаются еще до того, как АД изменится, предупреждая отклонение его от
нормы. Необходимые для этого реакции запускаются сигналами, возникающими в
рецепторах растяжения миокарда и коронарных сосудов, несущих информацию о
степени наполнения кровью полостей сердца и артериальной системы. В этом
случае регуляторные реакции реализуются через внутрисердечную нервную систему, а
также через вегетативные центры ЦНС.
Сосудистые рефлексы можно вызвать, раздражая рецепторы не только дуги аорты
или каротидного синуса, но и сосудов некоторых других областей тела. Так, при
повышении давления в сосудах легкого, кишечника, селезенки наблюдаются
рефлекторные изменения АД в других сосудистых областях.
Рефлекторная регуляция давления крови осуществляется при помощи не
только механорецепторов, но и хеморецепторов, чувствительных
к изменениям химического состава крови. Такие хеморецепторы сосредоточены в
аортальном и сонном гломусе (glomus caroticum, каротидные тельца), т. е. в
местах локализации хеморецепторов.
Хеморецепторы чувствительны к СО2 и недостатку кислорода в крови;
они раздражаются также СО, цианидами, никотином. От этих рецепторов возбуждение
по центростремительным нервным волокнам передается к сосудодвигательному центру
и вызывает повышение его тонуса. В результате сосуды суживаются и давление
повышается. Одновременно происходит возбуждение дыхательного центра.
Таким образом, возбуждение хеморецепторов аорты и сонной артерии вызывает
сосудистые прессорные рефлексы, а раздражение механорецепторов — депрессорные
рефлексы.
Хеморецепторы обнаружены также в сосудах селезенки, надпочечников,
почек, костного мозга. Они чувствительны к различным химическим соединениям,
циркулирующим в крови, например к ацетилхолину, адреналину и др. (В. Н.
Черниговский).
Сопряженные сосудистые рефлексы. Это рефлексы, возникающие в других
системах и органах, проявляются преимущественно повышением АД. Их можно
вызвать, например, раздражением поверхности тела. Так, при болевых
раздражениях рефлекторно суживаются сосуды, особенно органов брюшной полости, и
АД повышается. Раздражение кожи холодом также вызывает рефлекторное сужение
сосудов, главным образом кожных артериол.
Кортикальная регуляция сосудистого тонуса. Влияние коры большого мозга
на сосуды было впервые доказано путем раздражения определенных участков
коры.
Кортикальные сосудистые реакции у человека изучены методом условных
рефлексов. В этих опытах о сужении или расширении сосудов судят по изменению
объема руки при плетизмографии. Если сосуды суживаются, то кровенаполнение, а
следовательно, и объем органа уменьшаются. При расширении сосудов, наоборот,
кровенаполнение и объем органа увеличиваются.
Если многократно сочетать какое-либо раздражение, например согревание,
охлаждение или болевое раздражение участка кожи с каким-нибудь индифферентным
раздражителем (звуковым, световым и т. п.), то через некоторое число
подобных сочетаний один индифферентный раздражитель может вызвать такую же
сосудистую реакцию, как и безусловное раздражение.
Сосудистая реакция на ранее индифферентный раздражитель осуществляется
условнорефлекторным путем, т. е. при участии коры большого мозга. У человека при
этом часто возникает и соответствующее ощущение (холода, тепла или боли),
хотя никакого раздражения кожи не было.
Влиянием коры большого мозга объясняется то, что у спортсменов перед началом
упражнения или соревнования наблюдается повышение артериального давления,
вызванное изменениями деятельности сердца и сосудистого тонуса.
7.2.3.4. Гуморальные влияния на
сосуды
Одни гуморальные агенты суживают, а другие расширяют просвет артериальных
сосудов.
Сосудосуживающие вещества. К ним относятся гормоны мозгового
вещества надпочечников — адреналин и норадреналин, а также задней
доли гипофиза — вазопрессин.
Адреналин и норадреналин суживают артерии и артериолы кожи, органов брюшной
полости и легких, а вазопрессин действует преимущественно на артериолы и
капилляры.
Адреналин, норадреналин и вазопрессин оказывают влияние на сосуды в очень
малых концентрациях. Так, сужение сосудов у теплокровных животных происходит при
концентрации адреналина к крови 1*10 7 г/мл. Сосудосуживающий эффект
этих веществ обусловливает резкое повышение АД (рис. 7.23).
|
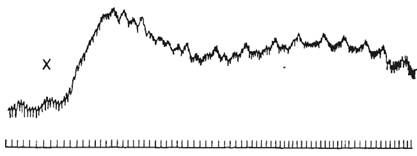
|
|
Рис. 7.23. Влияние адреналина на артериальное давление
собаки.
X — момент внутривенного введения 1 мг адреналина собаке с
перерезанными блуждающими нервами. Отметка времени
1 с.
|
К числу гуморальных сосудосуживающих факторов относится серотонин
(5-гидроокситриптамин), продуцируемый в слизистой оболочке кишечника и в
некоторых участках головного мозга. Серотонин образуется также при распаде
тромбоцитов. Физиологическое значение серотонина в данном случае состоит в
том, что он суживает сосуды и препятствует кровотечению из пораженного
сосуда. Во второй фазе свертывания крови, развивающейся после образования
тромба, серотонин расширяет сосуды.
Особый сосудосуживающий фактор — ренин, образуется в почках, причем
тем в большем количестве, чем ниже кровоснабжение почек. По этой причине после
частичного сдавливания почечных артерий у животных возникает стойкое повышение
артериального давления, обусловленное сужением артериол. Ренин представляет
собой протеолитический фермент. Сам ренин не вызывает сужения сосудов, но,
поступая в кровь, расщепляет α2-глобулин плазмы —
ангиотензиноген и превращает его в относительно малоактивный дека-пептид
— ангиотензин I. Последний под влиянием фермента
дипептидкарбоксипептидазы превращается в очень активное сосудосуживающее
вещество ангиотензин II. Ангиотензин II быстро разрушается в
капиллярах ангиотензиназой.
В условиях нормального кровоснабжения почек образуется сравнительно
небольшое количество ренина. В большом количестве он продуцируется при падении
уровня давления крови по всей сосудистой системе. Если понизить давление крови у
собаки путем кровопускания, то почки выделят в кровь повышенное количество
ренина, что будет способствовать нормализации АД.
Открытие ренина и механизма его сосудосуживающего действия представляет
большой клинический интерес: оно объяснило причину высокого АД, сопутствующего
некоторым заболеваниям почек (гипертензия почечного происхождения).
Сосудорасширяющие вещества. В почках образуется также и
сосудорасширяющее вещество, названное медуллином (вырабатывается в
мозговом слое почки). Это вещество представляет собой липид.
В настоящее время известно образование во многих тканях тела ряда
сосудорасширяющих веществ, получивших название простагландинов. Такое
название дано потому, что впервые эти-вещества были найдены в семенной жидкости
у мужчин и предполагалось, что их образует предстательная железа. Простагландины
представляют собой производные ненасыщенных жирных кислот.
Из подчелюстной, поджелудочной желез, из легких и некоторых других органов
получен активный сосудорасширяющий полипептид брадикинин. Он вызывает
расслабление гладкой мускулатуры артериол и понижает уровень АД. Брадикинин
появляется в коже при действии тепла и является одним из факторов,
обусловливающих расширение сосудов при нагревании. Он образуется при расщеплении
одного из глобулинов плазмы крови под влиянием находящегося в тканях фермента
калликреина.
К сосудорасширяющим веществам относится ацетилхолин (АХ), который
образуется в окончаниях парасимпатических нервов и симпатических
вазодилататоров. Он быстро разрушается в крови, поэтому его действие на
сосуды в физиологических условиях чисто местное.
Сосудорасширяющим веществом является также гистамин — вещество,
образующееся в слизистой оболочке желудка и кишечника, а также во многих
других органах, в частности в коже при ее раздражении и в скелетной мускулатуре
во время работы. Гистамин расширяет артериолы и увеличивает кровенаполнение
капилляров. При введении 1—2 мг гистамина в вену кошке, несмотря на то что
сердце продолжает работать с прежней силой, уровень АД резко падает вследствие
уменьшения притока крови к сердцу: очень большое количество крови животного
оказывается сосредоточенным в капиллярах, главным образом брюшной полости.
Снижение АД и нарушение кровообращения при этом подобны тем, какие возникают при
большой кровопотере. Они сопровождаются нарушением деятельности ЦНС
вследствие расстройства мозгового кровообращения. Совокупность перечисленных
явлений объединяется понятием «шок». Тяжелые нарушения, возникающие в
организме при введении больших доз гистамина, называют гистаминовым
шоком.
Усиленным образованием и действием гистамина объясняют реакцию
покраснения кожи. Эта реакция вызывается влиянием раз- личных раздражений,
например потирание кожи, тепловое воздействие, ультрафиолетовое облучение.
Кроме гистамина и АХ, еще ряд других сосудорасширяющих веществ усиленно
высвобождается из связанного состояния или образуется в скелетной мускулатуре
при ее работе: АТФ и продукты ее распада (в частности, адениловая кислота),
молочная и угольная кислоты и др.
7.2.3.4. Местные механизмы
регуляции кровообращения
При усиленной функции любого органа или ткани возрастает интенсивность
процессов метаболизма и повышается концентрация продуктов обмена (метаболитов) —
оксида углерода (IV) СО2 и угольной кислоты, аденозиндифосфата,
фосфорной и молочной кислот и других веществ. Увеличивается осмотическое
давление (вследствие появления значительного количества низкомолекулярных
продуктов), уменьшается величина рН в результате накопления водородных
ионов. Все это и ряд других факторов приводят к расширению сосудов в работающем
органе. Гладкая мускулатура сосудистой стенки очень чувствительна к
действию этих продуктов обмена.
Попадая в общий кровоток и достигая с током крови сосудодвигательного центра,
многие из этих веществ повышают его тонус. Возникающее при центральном действии
указанных веществ генерализованное повышение тонуса сосудов в организме приводит
к увеличению системного АД при значительном возрастании кровотока через
работающие органы.
В скелетной мышце в состоянии покоя на 1 мм2 поперечного сечения
приходится около 30 открытых, т. е. функционирующих, капилляров, а при
максимальной работе мышцы число открытых капилляров на 1 мм2
возрастает в 100 раз.
Минутный объем крови, нагнетаемый сердцем при интенсивной физической работе,
может увеличиться не более чем в 5—6 раз, поэтому возрастание кровоснабжения
работающих мышц в 100 раз возможно лишь вследствие перераспределения крови. Так,
в период пищеварения наблюдается усиленный приток крови к пищеварительным
органам и уменьшение кровоснабжения кожи и скелетной мускулатуры. Во время
умственного напряжения усиливается кровоснабжение мозга.
Напряженная мышечная работа ведет к сужению сосудов пищеварительных
органов и усиленному притоку крови к работающим скелетным мышцам. Приток крови к
этим мышцам возрастает в результате местного сосудорасширяющего действия
продуктов обмена, образующихся в работающих мышцах, а также вследствие
рефлекторного расширения сосудов. Так, при работе одной руки сосуды расширяются
не только в этой, но и в другой руке, а также в нижних конечностях.
Высказано предположение, что в сосудах работающего органа тонус мышц
понижается не только вследствие накопления продуктов обмена, но и в
результате воздействия механических факторов: сокращение скелетных мышц
сопровождается растяжением сосудистых стенок, уменьшением сосудистого тонуса в
данной области и, следовательно, значительным увеличением местного
кровообращения.
Кроме продуктов обмена, накапливающихся в работающих органах и тканях,
на мышцы сосудистой стенки влияют и другие гуморальные факторы: гормоны,
ионы и т. д. Так, гормон мозгового вещества надпочечников адреналин вызывает
резкое сокращение гладких мышц артериол внутренних органов и вследствие этого
значительный подъем системного АД. Адреналин усиливает также сердечную
деятельность, однако сосуды работающих скелетных мышц и сосуды
головного мозга под влиянием адреналина не суживаются. Таким образом,
выброс в кровь большого количества адреналина, образующегося при эмоциональных
напряжениях, значительно повышает уровень системного АД и одновременно
улучшает кровоснабжение мозга и мышц и тем самым приводит к мобилизации
энергетических и пластических ресурсов организма, необходимых в чрезвычайных
условиях, при которых возникает эмоциональное напряжение.
Сосуды ряда внутренних органов и тканей обладают индивидуальными
особенностями регуляции, которые объясняются структурой и функцией каждого из
этих органов или тканей, а также степенью их участия в тех или иных общих
реакциях организма. Например, сосуды кожи играют важную роль в теплорегуляции.
Расширение их при повышении температуры тела способствует отдаче тепла в
окружающую среду, а сужение снижает теплоотдачу.
Перераспределение крови происходит также при переходе из горизонтального
положения в вертикальное. При этом затрудняется венозный отток крови от ног и
количество крови, поступающей в сердце по нижней полой вене, уменьшается (при
рентгеноскопии четко видно уменьшение размеров сердца). Вследствие этого
венозный приток крови к сердцу может значительно уменьшаться.
В последние годы установлена важная роль эндотелия сосудистой стенки в
регуляции кровотока. Эндотелий сосудов синтезирует и выделяет факторы, активно
влияющие на тонус гладких мышц сосудов. Клетки эндотелия — эндотелиоциты
под влиянием химических раздражителей, приносимых кровью, или под влиянием
механического раздражения (растяжение) способны выделять вещества,
непосредственно действующие на гладкие мышечные клетки сосудов, вызывая их
сокращение или расслабление. Срок жизни этих веществ мал, поэтому действие их
ограничивается сосудистой стенкой и не распространяется обычно на другие
гладкомышечные органы. Одними из факторов, вызывающих расслабление сосудов,
являются, по-видимому, нитраты и нитриты. Возможным сосудосуживающим
фактором является вазоконстрикторный пептид эндотелии, состоящий из 21
аминокислотного остатка.
7.2.3.6. Регуляция объема
циркулирующей крови
Для нормального кровоснабжения органов и тканей, поддержания постоянства АД
необходимо определенное соотношение между объемом циркулирующей крови (ОЦК)
и общей емкостью всей сосудистой системы. Это соответствие достигается при
помощи ряда нервных и гуморальных регуляторных механизмов.
Рассмотрим реакции организма на уменьшение ОЦК при кровопотере. В подобных
случаях приток крови к сердцу уменьшается и уровень АД снижается. В ответ на это
возникают реакции, направленные на восстановление нормального уровня АД.
Прежде всего происходит рефлекторное сужение артерий. Кроме того, при
кровопотере наблюдается рефлекторное усиление секреции сосудосуживающих
гормонов: адреналина — мозговым слоем надпочечников и вазопрессина — задней
долей гипофиза, а усиление секреции этих веществ приводит к сужению артериол. О
важной роли адреналина и вазопрессина в поддержании АД при кровопотере
свидетельствует тот факт, что смерть при потере крови наступает раньше, чем
после удаления гипофиза и надпочечников. Помимо симпатоадреналовых влияний и
действия вазопрессина, в поддержании АД и ОЦК на нормальном уровне при
кровопотере, особенно в поздние сроки, участвует система
ренин—ангиотензин—альдостерон. Возникающее после кровопотери снижение
кровотока в почках приводит к усиленному выходу ренина и большему, чем в норме,
образованию ангиотензина II, который поддерживает АД. Кроме того, ангиотензин II
стимулирует выход из коркового вещества надпочечников альдостерона, который,
во-первых, способствует поддержанию АД за счет увеличения тонуса симпатического
отдела вегетативной нервной системы, а во-вторых, усиливает реабсорбцию в почках
натрия. Задержка натрия является важным фактором увеличения реабсорбции воды в
почках и восстановления ОЦК.
Для поддержания АД при открытых кровопотерях имеет значение также переход в
сосуды тканевой жидкости и в общий кровоток того количества крови, которое
сосредоточено в так называемых кровяных депо. Выравниванию давления крови
способствует также рефлекторное учащение и усиление сокращений сердца. Благодаря
этим нейрогуморальным влияниям при быстрой потере 20—25% крови некоторое
время может сохраняться достаточно высокий уровень АД.
Существует, однако, некоторый предел потери крови, после которого никакие
регуляторные приспособления (ни сужение сосудов, ни выбрасывание крови из
депо, ни усиленная работа сердца и т. д.) не могут удержать АД на нормальном
уровне: если организм быстро теряет более 40—50% содержащейся в нем крови, то АД
резко понижается и может упасть до нуля, что приводит к смерти.
Указанные механизмы регуляции сосудистого тонуса являются безусловными,
врожденными, но в течение индивидуальной жизни животных на их основе
вырабатываются сосудистые условные рефлексы, благодаря которым
сердечно-сосудистая система включается в реакции, необходимые организму при
действии лишь одного сигнала, предшествующего тем или иным изменениям
окружающей среды. Таким образом организм оказывается заранее
приспособленным к предстоящей деятельности.
7.2.3.7. Кровяное депо
В состоянии покоя у человека до 45—50% всего объема крови, имеющейся в
организме, находится в кровяных депо: селезенке, печени, подкожном сосудистом
сплетении и легких. В селезенке содержится 500 мл крови, которая может быть
почти полностью выключена из циркуляции.
Резервуарная функция селезенки. Осуществляется благодаря особой
структуре ее сосудов. Кровь из капилляров поступает сначала в венозные синусы и
лишь затем переходит в вены. Синусы имеют легко растяжимые стенки и могут
вмещать большое количество крови и, опорожняясь, изливать эту кровь в
селезеночную вену и, следовательно, в общий кровоток.
В селезеночных артериях и селезеночных синусах у места впадения их в
венулы имеются сфинктеры, регулирующие приток и отток крови. При сокращении
венозных сфинктеров отток крови затрудняется и кровь задерживается в синусах,
вызывая увеличение размеров селезенки. При этом сфинктеры обычно сдавливают
просвет сосудов не полностью. Остаются узкие просветы, задерживающие форменные
элементы крови, но пропускающие плазму. При открытых артериальных
сфинктерах приток крови в селезенку не ограничен, давление в ее сосудах
растет и повышается уровень фильтрационного давления, вследствие чего
плазма крови проходит через венозные сфинктеры в вены и общий кровоток.
Благодаря этому кровь в сосудах селезенки сгущается. Селезенка может вместить до
1/5 эритроцитов всей крови организма.
При физических и эмоциональных напряжениях влияния, идущие к селезенке
по симпатическим волокнам, а также адреналин, выбрасываемый в кровь мозговым
веществом надпочечников, вызывают сокращение гладкой мускулатуры капсулы,
трабекул и сосудов в данном органе. Венозные сфинктеры при этом открываются и
депонированная в селезенке кровь выбрасывается в общий кровоток. В кровоток
поступает дополнительно и большое количество эритроцитов. Таким образом,
селезенка является основным депо эритроцитов. Большое количество их,
поступая в циркулирующую кровь при физических и эмоциональных напряжениях,
значительно повышает кислородную емкость крови.
Гладкие мышцы селезенки могут сокращаться под влиянием импульсов, поступающих
из коры большого мозга, т. е. условно-рефлекторным путем. Вследствие этого любые
сигналы о предстоящей физической нагрузке или эмоциональном напряжении
могут вызывать сокращение гладких мышц селезенки и выход в кровь большого
количества эритроцитов. Организм оказывается заблаговременно подготовленным
к предстоящим физическим и эмоциональным нагрузкам. Выход крови из
селезенки наблюдается также при кровопотерях, ожогах, травмах, гипоксии,
асфиксии, анестезии и при ряде других состояний.
Депонирующая роль печени и кожи. Кровь, находящаяся в сосудах печени и
сосудистом сплетении кожи (у человека до 1 л), циркулирует значительно медленнее
(в 10—20 раз), чем в других сосудах. Поэтому кровь в данных органах
задерживается, т. е. они также являются как бы резервуарами крови.
Большую роль в качестве депо крови играет печень. В стенках крупных ветвей
печеночных вен имеются мышечные пучки, образующие сфинктеры, которые,
сокращаясь, суживают устье вен, что препятствует оттоку крови от печени. Кровь,
находящаяся в печени, не выключается из циркуляции, как это происходит в
селезенке, но ее движение замедляется. Регуляция кровенаполнения печени, а
следовательно, ее функция как депо крови осуществляется рефлекторным путем.
Роль депо крови выполняют вся венозная система и в наибольшей степени вены
кожи.
7.2.4. Регионарное
кровообращение
Каждые орган и ткань: мозг, сердце, легкие, печень, кожа, мышцы — обладают
индивидуальными физиологическими особенностями кровообращения.
Непрерывность движения крови в организме человека обеспечивается как
системой последовательно соединенных сосудов, осуществляющих системную
гемодинамику, так и системой параллельно подключенных к аорте и полым венам
сосудистых русел, представленных сосудами различных органов и
обеспечивающих регионарную гемодинамику. Хотя в каждом отдельно взятом органе
(регионе) кругооборот крови в процессе ее движения не совершается, для
обозначения гемодинамики в органах употребляется термин
«регионарное кровообращение».
Главное назначение кровообращения, в обеспечении обмена газами,
веществами и продуктами их метаболизма, а также тепловой энергией между кровью и
клетками тканей, реализуется на уровне сосудистой системы органов. Именно здесь
осуществляется непосредственное соприкосновение обменных сосудов с
тканевыми элементами, а структурные особенности строения стенки кровеносных
капилляров и низкая линейная скорость кровотока в них создают оптимальные
условия для полноценного осуществления обменно-транспортной функции
кровообращения. Кроме того, процессы непрерывного приспособления организма
к постоянно изменяющимся условиям внешней и внутренней среды вовлекают в
активную деятельность различные регионы и группы органов. Это требует
четкой координации и высокой надежности в адекватном перераспределении крови
между работающими органами. Наконец, сосудистые сети органов, выполняя в общей
схеме устройства сердечно-сосудистой системы роль параллельно включенных
проводников, в значительной мере определяют величину общего периферического
сопротивления сосудов и тем самым влияют на показатели системной
гемодинамики.
В то время как кровообращение в мышцах и большинстве внутренних органов
определяется общими принципами и закономерностями, описанными выше,
кровообращение в ряде регионов требует специального рассмотрения.
7.2.4.1. Мозговое
кровообращение
Головной мозг характеризуется непрерывно протекающими энергоемкими
процессами, требующими потребления глюкозы мозговой тканью. Известно, что
нервная ткань практически не обладает ни субстратом для анаэробных окислительных
процессов, ни запасами кислорода, а следовательно, для нормального
функционирования мозга необходима высокая интенсивность его кровоснабжения. В
связи с этим головной мозг, средняя масса которого 1400—1500 г, в состоянии
функционального покоя получает около 750 мл/мин крови, что составляет
примерно 15% от сердечного выброса. Объемная скорость кровотока при этих
условиях соответствует 50— 60 мл/100 г/мин. Следует отметить, что серое вещество
обеспечивается кровью интенсивнее, чем белое, что обусловлено более
высокой клеточной активностью. У детей первого года жизни величина
кровотока на 50—55% больше, а в старческом возрасте примерно на 20% меньше, чем
у человека в зрелом возрасте. Снижение интенсивности кровоснабжения головного
мозга чревато развитием дефицита кислорода и глюкозы в мозговой ткани, что может
привести к нарушениям деятельности мозга. В здоровом организме, благодаря
надежным механизмам ауторегуляции мозгового кровотока, питание мозга
остается практически неизменным при падении системного АД вплоть до 50 мм
рт.ст.
Регуляция мозгового кровообращения. Известно, что мозг расположен в
ригидном костном образовании — черепе (исключение составляют дети грудного
возраста, у которых имеются роднички, придающие некоторую подвижность стенкам
черепной коробки). Поскольку в полости черепа, помимо мозгового вещества,
содержатся кровь и цереброспинальная жидкость, являющиеся малосжимаемыми
жидкостями, их общий объем остается почти постоянным. При избыточности
кровоснабжения может произойти излишняя гидратация ткани мозга с
последующим развитием отека мозга и повреждениями, несовместимыми с жизнью,
жизненно важных центров. Основной причиной избыточности кровоснабжения головного
мозга может служить увеличение системного АД, однако в норме при участии
ауторегуляторных сосудистых реакций мозг предохранен от избыточного
кровенаполнения при повышении давления вплоть до 160—170 мм рт. ст. Помимо
ауторегуляции кровотока, предохранение головного мозга как органа, близко
расположенного к сердцу, от высокого кровяного давления и избыточности пульсации
осуществляется и за счет особенностей строения сосудистой системы мозга. В
частности, эту функцию достаточно эффективно выполняют многочисленные изгибы
(сифоны) по ходу сосудистого русла, которые способствуют значительному перепаду
давления и сглаживанию пульсирующего кровотока.
В активно работающем мозге возникает потребность в увеличении интенсивности
кровоснабжения. Благодаря феномену функциональной (рабочей) гиперемии такая
возросшая потребность полностью удовлетворяется, не вступая в противоречие с
необходимостью предотвращения головного мозга от избыточности кровенаполнения.
Объясняется это специфическими особенностями мозгового кровообращения.
Во-первых, при повышенной активности всего организма (усиленная физическая
работа, эмоциональное возбуждение и т. д.) кровоток в мозге увеличивается
примерно на 20—25%, что не оказывает повреждающего действия, поскольку мозг —
единственный орган, основной сосудистый бассейн которого располагается на
поверхности (система сосудов мягкой мозговой оболочки) и, за счет расстояния до
твердой мозговой оболочки, располагает резервом для некоторого кровенаполнения.
Во-вторых, физиологически активное состояние человека (включая умственную
деятельность) характеризуется развитием процесса активации в строго
соответствующих нервных центрах (корковых представительствах функций), где и
формируются доминантные очаги. В таком случае нет необходимости в увеличении
суммарного мозгового кровотока, а лишь требуется внутримозговое
перераспределение кровотока в пользу активно работающих зон (областей,
участков) мозга. Эта функциональная потребность реализуется путем активных
сосудистых реакций, развивающихся в пределах соответствующих сосудистых
модулей — структурно-функциональных единиц микрососудистой системы
головного мозга. Следовательно, особенностью мозгового кровообращения
является высокая гетерогенность и изменчивость распределения локального
кровотока в микроучастках нервной ткани.
7.2.4.2. Венечное
кровообращение
Поперечнополосатая мускулатура сердца в отличие от скелетной характеризуется
высоким потреблением энергии аэробного происхождения, что обусловливает
значительную потребность миокарда в интенсивном кровоснабжении. Доставка
артериальной крови в миокард осуществляется венечными (коронарными) артериями,
которые, разветвляясь и широко анастомозируя во всех слоях и отделах
сердца, образуют густую сеть капилляров и практически каждое мышечное волокно
снабжено собственным обменным сосудом. Венозный отток от миокарда
осуществляется через широкий венечный (коронарный) синус, открывающийся в
полость правого предсердия. Прекращение кровотока по коронарным артериям при их
закупорке или значительном спазме приводит к стойкому снижению
кровоснабжения сердечной мышцы и к развитию инфаркта миокарда, что
сопровождается нарушением нагнетательной функции сердца и может привести к
смерти. Поскольку в системе коронарного русла достаточно хорошо представлен
модульный принцип организации, аналогичные изменения кровотока в пределах
отдельных сосудистых модулей могут проявиться в виде микроинфарктов,
осложняющихся нарушением проводимости и сократимости сердечной мышцы.
В состоянии функционального покоя у взрослого человека коронарный
кровоток составляет 60—70 мл/100 г/ мин. От общего сердечного выброса
кровоснабжение миокарда составляет 4—5%, т.е. в среднем 200—250 мл/мин. В
условиях интенсивной физической работы, когда происходит активация сердечной
деятельности, объемная скорость кровотока в сердечной мышце возрастает,
достигая 350—400 мл/100 г/мин (функциональная гиперемия).
Коронарный кровоток существенно изменяется в зависимости от периода
сердечного цикла. В период систолы желудочков интенсивность коронарного
кровотока (особенно в миокарде левого желудочка) снижается, а во время
диастолы увеличивается. Описанные периодические колебания объясняются двумя
основными причинами: первая из них обусловлена пульсирующим характером давления
в аорте, а вторая (основная) — изменениями напряжения в стенке миокарда. В
систолу, когда это напряжение значительно возрастает, сдавливаются сосуды
среднего и внутреннего слоев миокарда, движение крови в левой коронарной
артерии затруднено. В диастолу напряжение в миокарде падает, проходимость
сосудов восстанавливается и кровоток увеличивается. В увеличении кровотока
через миокард в период диастолы не исключена роль реактивной (постокклюзионной)
гиперемии.
Несмотря на выраженное снижение кровотока во время систолы, метаболические
потребности миокарда при нормальной частоте сокращений сердца полностью
удовлетворяются за счет ряда функциональных особенностей: 1) высокой
экстракцией кислорода миоглобином мышцы сердца (до 75%); 2) высокой объемной
скоростью кровотока в миокарде; 3) высокой растяжимостью коронарных
сосудов; 4) фазными колебаниями кровотока в венах сердца
противоположной направленности, а именно ускорением оттока крови в систолу
и замедлением его в диастолу. Вместе с тем в условиях тахикардии, когда
происходит укорочение диастолы, эти функциональные особенности в меньшей
степени компенсируют систолическое ограничение кровоснабжения сердца.
Регуляция венечного кровообращения. Представлена местными и дистантными
механизмами. Для сосудов миокарда характерна высокая выраженность базального
тонуса, а также миогенная метаболическая активность гладких мышечных клеток
(ГМК). Диапазон ауторегуляции кровотока в сердечной мышце находится в
пределах 70—160 мм рт.ст. Метаболическая регуляция коронарных сосудов проявляет
наибольшую активность по отношению к тканевому рО2,
концентрациям аденозина и метаболитам макроэргических соединений.
Вопрос о характере нервной регуляции коронарного кровообращения не до
конца ясен. Считают, что симпатические адренергические нервные волокна вызывают
в ряде случаев (физическая работа, стенические отрицательные эмоции) расширение
венечных сосудов и увеличение кровотока в миокарде. Наряду с этим в других
условиях (астенические отрицательные эмоции, боль и т. п.) наблюдаются
симпатические коронаросуживающие эффекты. Причины таких противоположных влияний
связывают с избирательной «настройкой» чувствительности α- и
β-адренорецепторов, широко представленных в ГМК коронарных сосудов,
а также с концентрацией катехоламинов, которые в зависимости от «дозы-эффекта»
вмешиваются в метаболизм ГМК и интерстициальной ткани. Парасимпатические
холинергические влияния скорее всего опосредованно, угнетая сократительную
активность сердечной мышцы, снижают ее метаболические потребности и тем самым
приводят к снижению кровоснабжения миокарда.
7.2.4.3. Легочное
кровообращение
Важнейшей особенностью организации кровоснабжения легких является ее
двухкомпонентный характер, поскольку легкие получают кровь из сосудов малого
круга кровообращения и бронхиальных сосудов большого круга кровообращения.
Функциональное значение сосудистой системы малого круга кровообращения состоит в
обеспечении газообменной функции легких, тогда как бронхиальные сосуды
удовлетворяют собственные циркуляторно-метаболические потребности легочной
ткани.
Легочная артерия и ее ветви диаметром более 1 мм являются сосудами
эластического типа, что способствует значительному сглаживанию пульсации
крови, поступающей во время систолы правого желудочка в легкие. Более мелкие
артерии (диаметром от 1 мм до 100 мкм) относят к артериям мышечного типа. Они
обусловливают величину гидродинамического сопротивления в малом круге
кровообращения. В самых мелких артериях (диаметром менее 100 мкм) и в
артериолах содержание ГМК прогрессивно снижается и в артериолах диаметром менее
45 мкм они полностью отсутствуют. Поскольку безмышечные артериолы тесно
связаны с окружающей альвеолярной паренхимой, интенсивность кровоснабжения
легких непосредственно зависит от интенсивности вентиляции альвеол.
Капилляры легких образуют на поверхности альвеол очень густую сеть и при этом
на одну альвеолу приходится несколько капилляров. В связи с тем что стенки
альвеол и капилляров тесно контактируют, образуя как бы единую
альвеолярно-капиллярную мембрану, создаются наиболее благоприятные условия
для эффективных вентиляционно-перфузионных взаимоотношений. В условиях
функционального покоя у человека капиллярная кровь находится в контакте с
альвеолярным воздухом в течение примерно 0,75 с. При физической работе
продолжительность контакта укорачивается более чем в два раза и составляет в
среднем 0,35 с.
В результате слияния капилляров образуются характерные для легочной
сосудистой системы безмышечные посткапиллярные венулы, трансформирующиеся в
венулы мышечного типа и далее в легочные вены. Особенностью сосудов венозного
отдела являются их тонкостенность и слабая выраженность ГМК. Структурные
особенности легочных сосудов, в частности артерий, определяют большую
растяжимость сосудистого русла, что создает условия для более низкого
сопротивления (приблизительно в 10 раз меньше, чем в системе большого круга
кровообращения), а следовательно, более низкого кровяного давления. В связи с
этим система малого круга кровообращения относится к области низкого давления.
Давление в легочной артерии составляет в среднем 15—25 мм рт.ст., а в венах —
6—8 мм рт.ст. Градиент давления равен примерно 9—17 мм рт.ст., т. е. значительно
меньше, чем в большом круге кровообращения. Несмотря на это, повышение
системного АД или же значительное увеличение кровотока (при активной физической
работе человека) существенно не влияет на трансмуральное давление в
легочных сосудах из-за их большей растяжимости. Большая растяжимость
легочных сосудов определяет еще одну важную функциональную особенность
этого региона, заключающуюся в способности депонировать кровь и тем самым
предохранять легочную ткань от отека при увеличении минутного объема
кровотока.
Минутный объем крови в легких соответствует минутному объему крови в большом
круге кровообращения и в условиях функционального покоя составляет в
среднем 5 л/мин. При активной физической работе этот показатель может возрасти
до 25 л/мин.
Распределение кровотока в легких характеризуется неравномерностью
кровоснабжения верхних и нижних долей, так как низкое внутрисосудистое давление
определяет высокую зависимость легочного кровотока от гидростатического
давления. Так, в вертикальном положении верхушки легкого расположены выше
основания легочной артерии, что практически уравнивает АД в верхних долях легких
с гидростатическим давлением. По этой причине капилляры верхних долей слабо
перфузируются, тогда как в нижних долях благодаря суммированию АД с
гидростатическим давлением кровоснабжение обильное. Описанная особенность
легочного кровообращения играет важную роль в установлении
перфузионно-вентиляционных отношений в дыхательной системе.
Интенсивность кровоснабжения легких зависит от циклических изменений
плеврального и альвеолярного давлений в различные фазы дыхательного цикла. Во
время вдоха, когда плевральное и альвеолярное давление уменьшаются, происходит
пассивное расширение крупных внелегочных и внутрилегочных сосудов,
сопротивление сосудистого русла дополнительно снижается и кровоснабжение
легких в фазу вдоха увеличивается.
Регуляция легочного кровообращения. Местная регуляция легочного
кровотока в основном представлена метаболическими факторами, ведущая роль среди
которых принадлежит рО2 и рСО2. При снижении
рО2 и/или повышении рСО2 происходит местная
вазоконстрикция легочных сосудов. Следовательно, особенностью местной регуляции
кровоснабжения легких является строгое соответствие интенсивности
локального кровотока уровню вентиляции данного участка легочной ткани.
Нервная регуляция легочного кровообращения осуществляется в основном
симпатическими сосудосуживающими волокнами. Природа сосудорасширяющих нервных
влияний пока не выяснена. Система легочного кровообращения выделяется среди всех
регионов наибольшей функциональной связью с центральной регуляцией
системной гемодинамики в большом круге кровообращения. Известно, что
рефлексы саморегуляции кровообращения с баро- и хеморецепторов сонного
(каротидного) синуса сопровождаются активными изменениями легочного
кровотока. В свою очередь сосуды малого круга кровообращения являются мощной
рефлексогенной зоной, порождающей рефлекторные изменения в сердечно-сосудистой
системе.
Гуморальная регуляция легочного кровообращения в значительной степени
обусловлена влиянием таких биологически активных веществ, как ангиотензин,
серотонин, гистамин, простагландины, которые вызывают в основном вазоконстрикцию
в легких и повышение кровяного давления в легочных артериях. Активность других,
широко распространенных в организме гуморальных факторов (адреналин,
норадреналин, ацетилхолин) в системе регуляции легочного кровотока выражена в
меньшей степени.
7.3. ЛИМФООБРАЩЕНИЕ
7.3.1. Строение лимфатической
системы
Лимфатическая система человека и теплокровных животных состоит из
следующих образований: 1) лимфатических капилляров, представляющих собой
замкнутые с одного конца эндотелиальные трубки, пронизывающие практически все
органы и ткани; 2) внутриорганных сплетений посткапилляров и мелких, снабженных
клапанами, лимфатических сосудов; 3) экстраорганных отводящих
лимфатических сосудов, впадающих в главные лимфатические стволы,
прерывающихся на своем пути лимфатическими узлами; 4) главных лимфатических
протоков — грудного и правого лимфатического, впадающих в крупные вены шеи.
Лимфатические капилляры и посткапилляры представляют собой часть лимфатической
системы; в них под влиянием изменяющихся градиентов гидростатического и
коллоидно-осмотического давлений происходит образование лимфы. Стенки
лимфатических капилляров и посткапилляров представлены одним слоем
эндотелиальных клеток, прикрепленных с помощью коллагеновых волокон к
окружающим тканям. В стенке лимфатических капилляров между эндотелиальными
клетками имеется большое количество пор, которые при изменении градиента
давления могут открываться и закрываться. Внутри- и внеорганные лимфатические
сосуды, лимфатические стволы и протоки выполняют преимущественно транспортную
функцию, обеспечивая доставку образовавшейся в лимфатической системе лимфы
в систему кровеносных сосудов. Лимфатические сосуды являются системой
коллекторов, представляющих собой цепочки лимфангионов. Лимфангион
является морфофункциональной единицей лимфатических сосудов и состоит
из мышечной «манжетки», представленной спиралеобразно расположенными гладкими
мышечными клетками и двух клапанов — дистального и проксимального. Крупные
лимфатические сосуды конечностей и внутренних органов сливаются в грудной и
правый лимфатический протоки. Из протоков лимфа поступает через правую и левую
подключичную вены в общий кровоток.
7.3.2. Образование лимфы
Лимфа — жидкость, возвращаемая в кровоток из тканевых пространств по
лимфатической системе. Лимфа образуется из тканевой (интерстициальной)
жидкости, накапливающейся в межклеточном пространстве в результате
преобладания фильтрации жидкости над реабсорбцией через стенку кровеносных
капилляров. Движение жидкости из капилляров и внутрь их определяется
соотношением гидростатического и осмотического давлений, действующих через
эндотелий капилляров. Осмотические силы стремятся удержать плазму внутри
кровеносного капилляра для сохранения равновесия с противоположно направленными
гидростатическими силами. Вследствие того что стенка кровеносных капилляров не
является полностью непроницаемой для белков, некоторое количество белковых
молекул постоянно просачивается через нее в интерстициальное пространство.
Накопление белков в тканевой жидкости увеличивает ее осмотическое давление
и приводит к нарушению баланса сил, контролирующих обмен жидкости через
капиллярную мембрану. В результате концентрация белков в интерстициальной
ткани повышается и белки по градиенту концентрации начинают поступать
непосредственно в лимфатические капилляры. Кроме того, движение белков
внутрь лимфатических капилляров осуществляется посредством пиноцитоза.
Утечка белков плазмы в тканевую жидкость, а затем в лимфу зависит от органа.
Так, в легких она равна 4%, в желудочно-кишечном тракте — 4,1%, сердце —
4,4%, в печени достигает 6,2%.
7.3.3. Состав лимфы
В состав лимфы входят клеточные элементы, белки, липиды, низкомолекулярные
органические соединения (аминокислоты, глюкоза, глицерин), электролиты.
Клеточный состав лимфы представлен в основном лимфоцитами. В лимфе грудного
протока их число достигает 8*109/л. Эритроциты в лимфе в норме
встречаются в ограниченном количестве, их число значительно возрастает при
травмах тканей, тромбоциты в норме не определяются. Макрофаги и моноциты
встречаются редко. Гранулоциты могут проникать в лимфу из очагов инфекции.
Ионный состав лимфы не отличается от ионного состава плазмы крови и
интерстициальной жидкости. В то же время по содержанию и составу белков и
липидов лимфа значительно отличается от плазмы крови. В лимфе человека
содержание белков составляет в среднем 2—3% от объема. Концентрация белков
в лимфе зависит от скорости ее образования: увеличение поступления жидкости в
организм вызывает рост объема образующейся лимфы и уменьшает концентрацию
белков в ней. В лимфе в небольшом количестве содержатся все факторы свертывания,
антитела и различные ферменты, имеющиеся в плазме. Холестерин и фосфолипиды
находятся в лимфе в виде липопротеинов. Содержание свободных жиров, которые
находятся в лимфе в виде хиломикронов, зависит от количества жиров, поступивших
в лимфу из кишечника. Тотчас после приема пищи в лимфе грудного протока
содержится большое количество липопротеинов и липидов, всосавшихся в
желудочно-кишечном тракте. Между приемами пищи содержание липидов в грудном
протоке минимально.
7.3.4. Движение лимфы
Скорость и объем лимфообразования определяются процессами микроциркуляции и
взаимоотношением системной и лимфатической циркуляции. Так, при минутном объеме
кровообращения, равном 6 л, через стенки кровеносных капилляров в организме
человека фильтруется около 15 мл жидкости. Из этого количества 12 мл жидкости
реабсорбируется. В интерстициальном пространстве остается 3 мл жидкости,
которая в дальнейшем возвращается в кровь по лимфатическим сосудам. Если учесть,
что за час в крупные лимфатические сосуды поступает 150—180 мл лимфы, а за сутки
через грудной лимфатический проток проходит до 4 л лимфы, которая в дальнейшем
поступает в общий кровоток, то значение возврата лимфы в кровь становится весьма
ощутимым.
Движение лимфы начинается с момента ее образования в лимфатических
капиллярах, поэтому факторы, которые увеличивают скорость фильтрации жидкости из
кровеносных капилляров, будут также увеличивать скорость образования и движения
лимфы. Факторами, повышающими лимфообразование, являются увеличение
гидростатического давления в капиллярах, возрастание общей поверхности
функционирующих капилляров (при повышении функциональной активности
органов), увеличение проницаемости капилляров, введение гипертонических
растворов. Роль лимфообразования в механизме движения лимфы заключается в
создании первоначального гидростатического давления, необходимого для
перемещения лимфы из лимфатических капилляров и посткапилляров в отводящие
лимфатические сосуды.
В лимфатических сосудах основной силой, обеспечивающей перемещение лимфы
от мест ее образования до впадения протоков в крупные вены шеи, являются
ритмические сокращения лимфангионов. Лимфангионы, которые можно рассматривать
как трубчатые лимфатические микросердца, имеют в своем составе все необходимые
элементы для активного транспорта лимфы: развитую мышечную «манжетку» и клапаны.
По мере поступления лимфы из капилляров в мелкие лимфатические сосуды происходит
наполнение лимфангионов лимфой и растяжение их стенок, что приводит к
возбуждению и сокращению гладких мышечных клеток мышечной «манжетки». Сокращение
гладких мышц в стенке лимфангиона повышает внутри него давление до уровня,
достаточного для закрытия дистального клапана и открытия проксимального. В
результате происходит перемещение лимфы в следующий центрипетальный
лимфангион. Заполнение лимфой проксимального лимфангиона приводит к
растяжению его стенок, возбуждению и сокращению гладких мышц и
перекачиванию лимфы в следующий лимфангион. Таким образом, последовательные
сокращения лимфангионов приводят к перемещению порции лимфы по
лимфатическим коллекторам до места их впадения в венозную систему. Работа
лимфангионов напоминает деятельность сердца. Как в цикле сердца, в цикле
лимфангиона имеются систола и диастола. По аналогии с гетерометрической
саморегуляцией в сердце, сила сокращения гладких мышц лимфангиона
определяется степенью их растяжения лимфой в диастолу. И наконец, как и в
сердце, сокращение лимфангиона запускается и управляется одиночным платообразным
потенциалом действия (рис. 7.24).
|
|
|
Рис. 7.24. Механизм движения лимфы по лимфатическим сосудам (по
Г. И. Лобову). А — лимфангион в фазе сокращенна; Б — лимфангион а фазе
заполнения; В — лимфангион в состоянии покоя; а — мышечная манжетка
лимфангиона: б — клапан; 1 — мембранный потенциал и потенциал действия
миоцитов лимфангиона; 2 — сокращение стенки лимфангиона; 3 — давление в
проекте лимфангиона. Стрелкой показано направление движения
лимфы.
|
Стенка лимфангионов имеет развитую иннервацию, которая в основном
представлена адренергическими волокнами. Роль нервных волокон в стенке
лимфангиона заключается не в побуждении их к сокращению, а в модуляции
параметров спонтанно возникающих ритмических сокращений. Кроме этого, при общем
возбуждении симпатико-адреналовой системы могут происходить тонические
сокращения гладких мышц лимфангионов, что приводит к повышению давления во
всей системе лимфатических сосудов и быстрому поступлению в кровоток
значительного количества лимфы. Гладкие мышечные клетки высокочувствительны к
некоторым гормонам и биологически активным веществам. В частности, гистамин,
увеличивающий проницаемость кровеносных капилляров и приводящий тем самым к
росту лимфообразования, увеличивает частоту и амплитуду сокращений гладких
мышц лимфангионов. Миоциты лимфангиона реагируют также на изменения
концентрации метаболитов, рО2 и повышение температуры.
В организме, помимо основного механизма, транспорту лимфы по сосудам
способствует ряд второстепенных факторов. Во время вдоха усиливается отток лимфы
из грудного протока в венозную систему, а при вдохе он уменьшается. Движения
диафрагмы влияют на ток лимфы — периодическое сдавление и растяжение диафрагмой
цистерны грудного протока усиливает заполнение ее лимфой и способствует
продвижению по грудному лимфатическому протоку. Повышение активности
периодически сокращающихся мышечных органов (сердце, кишечник, скелетная
мускулатура) влияет не только на усиление лимфооттока, но и способствует
переходу тканевой жидкости в капилляры. Сокращения мышц, окружающих
лимфатические сосуды, повышают внутрилимфатическое давление и
выдавливают лимфу в направлении, определяемом клапанами. При иммобилизации
конечности отток лимфы ослабевает, а при активных и пассивных ее движениях —
увеличивается. Ритмическое растяжение и массаж скелетных мышц способствуют
не только механическому перемещению лимфы, но и усиливают собственную
сократительную активность лимфангионов в этих мышцах.
7.3.5. Функции лимфатической
системы
Наиболее важной функцией лимфатической системы является возврат белков,
электролитов и воды из интерстициального пространства в кровь. За сутки в
составе лимфы в кровоток возвращается более 100 г белка, профильтровавшегося из
кровеносных капилляров в интерстициальное пространство. Нормальная
лимфоциркуляция необходима для формирования максимально концентрированной
мочи в почке. Через лимфатическую систему переносятся многие продукты,
всасывающиеся в желудочно-кишечном тракте, и прежде всего жиры. Некоторые
крупномолекулярные ферменты, такие как гистаминаза и липаза, поступают в кровь
исключительно по системе лимфатических сосудов. Лимфатическая система действует
как транспортная система по удалению эритроцитов, оставшихся в ткани после
кровотечения, а также по удалению и обезвреживанию бактерий, попавших в
ткани. Лимфатическая система продуцирует и осуществляет перенос лимфоцитов и
других важнейших факторов иммунитета. При возникновении инфекции в каких-либо
частях тела региональные лимфатические узлы воспаляются в результате задержки в
них бактерий или токсинов. В синусах лимфатических узлов, расположенных в
корковом и мозговом слоях, содержится эффективная фильтрационная система,
которая позволяет практически стерилизовать поступающую в лимфатические
узлы инфицированную лимфу.
В клинической лимфологии применяют различные способы введения
лекарственных препаратов непосредственно в лимфатическую систему.
Эндолимфотерапию применяют при лечении тяжелых воспалительных
процессов, а также раковых заболеваний. В последние годы появился новый способ
лечения — лимфотропная терапия. При лимфотропной терапии лекарственные
препараты поступают в лимфатическую систему при их внутримышечном или подкожном
введении.























