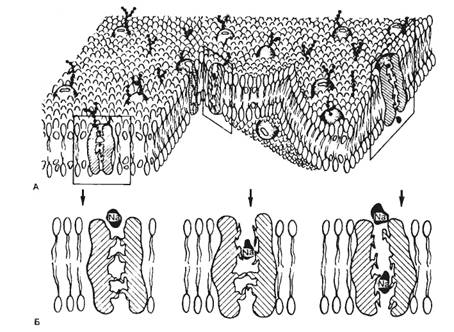
Рис. 2.1. Трехмерная жидкостно-мозаичная модель клеточной мембраны по Singer-Nikolson.
А — фосфолипидный бислой, в котором погружены белки; Б — различные моменты движения ионов Na+ через натриевый канал.
2.1. ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ
Основным свойством живых клеток является раздражимость, т. е. их способность реагировать изменением обмена веществ в ответ на действие раздражителей. Возбудимость — свойство клеток отвечать на раздражение возбуждением. К возбудимым относят нервные, мышечные и некоторые секреторные клетки. Возбуждение — ответ ткани на ее раздражение, проявляющийся в специфической для нее функции (проведение возбуждения нервной тканью, сокращение мышцы, секреция железы) и неспецифических реакциях (генерация потенциала действия, метаболические изменения).
Одним из важных свойств живых клеток является их электрическая возбудимость, т.е. способность возбуждаться в ответ на действие электрического тока. Высокая чувствительность возбудимых тканей к действию слабого электрического тока впервые была продемонстрирована Гальвани в опытах на нервно-мышечном препарате задних лапок лягушки. Если к нервно-мышечному препарату лягушки приложить две соединенные между собой пластинки из различных металлов, например медь—цинк, таким образом, что бы одна пластинка касалась мышцы, а другая — нерва, то мышца будет сокращаться (первый опыт Гальвани).
Детальный анализ результатов опытов Гальвани, проведенный А. Вольта, позволил сделать другое заключение: электрический ток возникает не в живых клетках, а в месте контакта разнородных металлов с электролитом, поскольку тканевые жидкости представляют собой раствор солей. В результате своих исследований А.Вольта создал устройство, получившее название «вольтов столб» — набор по следовательно чередующихся цинковых и серебряных пластинок, раз деленных бумагой, смоченной солевым раствором. В доказательство справедливости своей точки зрения Гальвани предложил другой опыт: набрасывать на мышцу дистальный отрезок нерва, который иннервирует эту мышцу, при этом мышца также сокращалась (второй опыт Гальвани, или опыт без металла). Отсутствие металлических про водников при проведении опыта позволило Гальвани подтвердить свою точку зрения и развить представления о «животном электричестве», т. е. электрических явлениях, возникающих в живых клетках. Окончательное доказательство существования электрических явлений в живых тканях было получено в опыте «вторичного тетануса» Маттеуччи, в котором один нервно-мышечный препарат возбуждался током, а биотоки сокращающейся мышцы раздражал нерв второго нервно-мышечного препарата.
В конце XIX века благодаря работам Л. Германа, Э. Дюбуа-Раймона, Ю. Бернштейна стало очевидно, что электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран.
2.1.1. Строение и основные свойства клеточных мембран и ионных каналов
Согласно современным представлениям, биологические мембраны образуют наружную оболочку всех животных клеток и формируют многочисленные внутриклеточные органеллы. Наиболее характерным структурным признаком является то, что мембраны всегда образуют замкнутые пространства, и такая микроструктурная организация мембран позволяет им выполнять важнейшие функции.
Строение и функции клеточных мембран.
1.Барьерная функция выражается в том, что мембрана при помощи соответствующих механизмов участвует в создании концентрационных градиентов, препятствуя свободной диффузии. При этом мембрана принимает участие в механизмах электрогенеза. К ним относятся механизмы создания потенциала покоя, генерация потенциала действия, механизмы распространения биоэлектрических импульсов по однородной и неоднородной возбудимым структурам.
2.Регуляторная функция клеточной мембраны заключается в тонкой регуляции внутриклеточного содержимого и внутриклеточных реакций за счет рецепции внеклеточных биологически активных веществ, что приводит к изменению активности ферментных систем мембраны и запуску механизмов вторичных «месенджеров» («посредников»).
3.Преобразование внешних стимулов неэлектрической природы в электрические сигналы (в рецепторах).
4.Высвобождение нейромедиаторов в синаптических окончаниях.
Современными методами электронной микроскопии была определена толщина клеточных мембран (6—12 нм). Химический анализ показал, что мембраны в основном состоят из липидов и белков, количество которых неодинаково у разных типов клеток. Сложность изучения молекулярных механизмов функционирования клеточных мембран обусловлена тем, что при выделении и очистке клеточных мембран нарушается их нормальное функционирование. В настоящее время можно говорить о нескольких видах моделей клеточной мембраны, среди которых наибольшее распространение получила жидкостно-мозаичная модель.
Согласно этой модели, мембрана представлена бислоем фосфолипидных молекул, ориентированных таким образом, что гидрофобные концы молекул находятся внутри бислоя, а гидрофильные направлены в водную фазу (рис. 2.1). Такая структура идеально подходит для образования раздела двух фаз: вне- и внутриклеточной.
|
|
|
Рис. 2.1. Трехмерная жидкостно-мозаичная модель клеточной мембраны по Singer-Nikolson. А — фосфолипидный бислой, в котором погружены белки; Б — различные моменты движения ионов Na+ через натриевый канал. |
В фосфолипидном бислое интегрированы глобулярные белки, полярные участки которых образуют гидрофильную поверхность в водной фазе. Эти интегрированные белки выполняют различные функции, в том числе рецепторную, ферментативную, образуют ионные каналы, являются мембранными насосами и переносчиками ионов и молекул.
Некоторые белковые молекулы свободно диффундируют в плоскости липидного слоя; в обычном состоянии части белковых молекул, выходящие по разные стороны клеточной мембраны, не изменяют своего положения. Здесь описана только общая схема строения клеточной мембраны и для других типов клеточных мембран возможны значительные различия.
Электрические характеристики мембран. Особая морфология клеточных мембран определяет их электрические характеристики, среди которых наиболее важными являются емкость и проводимость.
Емкостные свойства в основном определяются фосфолипидным бислоем, который непроницаем для гидратированных ионов и в то же время достаточно тонок (около 5 нм), чтобы обеспечивать эффективное разделение и накопление зарядов и электростатическое взаимодействие катионов и анионов. Кроме того, емкостные свойства клеточных мембран являются одной из причин, определяющих временные характеристики электрических процессов, протекающихщих на клеточных мембранах.
Проводимость (g) — величина, обратная электрическому сопротивлению и равная отношению величины общего трансмембранного тока для данного иона к величине, обусловившей его трансмембранной разности потенциалов.
Через фосфолипидный бислой могут диффундировать различные вещества, причем степень проницаемости (Р), т. е. способность клеточной мембраны пропускать эти вещества, зависит от разности концентраций диффундирующего вещества по обе стороны мембраны, его растворимости в липидах и свойств клеточной мембраны. Скорость диффузии для заряженных ионов в условиях постоянного поля в мембране определяется подвижностью ионов, толщиной мембраны, распределением ионов в мембране. Для неэлектролитов проницаемость мембраны не влияет на ее проводимость, поскольку неэлектролиты не несут зарядов, т. е. не могут переносить электрический ток.
Проводимость мембраны является мерой ее ионной проницаемости. Увеличение проводимости свидетельствует об увеличении количества ионов, проходящих через мембрану.
Строение и функции ионных каналов. Ионы Na+, K+, Са2+, Сl- проникают внутрь клетки и выходят наружу через специальные, заполненные жидкостью каналы. Размер каналов довольно мал (диаметр 0,5—0,7 нм). Расчеты показывают, что суммарная площадь каналов занимает незначительную часть поверхности клеточной мембраны.
Функцию ионных каналов изучают различными способами. Наиболее распространенным является метод фиксации напряжения, или «voltage-clamp» (рис. 2.2). Сущность метода заключается в том, что с помощью специальных электронных систем в процессе опыта изменяют и фиксируют на определенном уровне мембранный потенциал. При этом измеряют величину ионного тока, протекающего через мембрану. Если разность потенциалов постоянна, то в соответствии с законом Ома величина тока пропорциональна проводимости ионных каналов. В ответ на ступенчатую деполяризацию открываются те или иные каналы, соответствующие ионы входят в клетку по электрохимическому градиенту, т. е. возникает ионный ток, который деполяризует клетку. Это изменение регистрируется с помощью управляющего усилителя и через мембрану пропускается электрический ток, равный по величине, но противоположный по направлению мембранному ионному току. При этом трансмембранная разность потенциалов не изменяется. Совместное использование метода фиксации потенциала и специфических блокаторов ионных каналов привело к открытию различных типов ионных каналов в клеточной мембране.
|
|
|
Рис. 2.2. Метод фиксации напряжения «voltage-clamp». I — аксон; 2 — источник переменного потенциала; 3 — блок управления установки потенциала экспериментатором; 4 — усилитель обратной связи; 5 — система измерения величины тока. |
В настоящее время установлены многие типы каналов для различных ионов (табл. 2.1). Одни из них весьма специфичны, вторые, кроме основного иона, могут пропускать и другие ионы.
Изучение функции отдельных каналов возможно методом локальной фиксации потенциала «path-clamp»; рис. 2.3, А). Стеклянный микроэлектрод (микропипетка) заполняют солевым раствором, прижимают к поверхности мембраны и создают небольшое разрежение. При этом часть мембраны подсасывается к микроэлектроду. Если в зоне присасывания оказывается ионный канал, то регистрируют активность одиночного канала. Система раздражения и регистрации активности канала мало отличается от системы фиксации напряжения.
Таблица 2.1. Важнейшие ионные каналы и ионные токи возбудимых клеток
|
Тип канала
|
Функция |
Ток |
Блокатор канала |
|
Калиевый (в покое) |
Генерация потенциала покоя |
IK+ (утечка) |
ТЭА |
|
Натриевый |
Генерация потенциала действия |
INa+ |
ТТХ |
|
Кальциевый |
Генерация медленных потенциалов |
ICa2+ |
D-600, верапамил |
|
Калиевый (задержанное выпрямление) |
Обеспечение реполяризации |
IK+ (задержка) |
ТЭА |
|
Калиевый кальций-активируемый |
Ограничение деполяризации, обусловленной током Са2+ |
IK+Ca2+ |
ТЭА |
Примечание. ТЭА — тетраэтиламмоний; ТТХ — тетродотоксин.
Ток через одиночный ионный канал имеет прямоугольную форму и одинаков по амплитуде для каналов различных типов (рис. 2.3, Б). Длительность пребывания канала в открытом состоянии имеет вероятностный характер, но зависит от величины мембранного потенциала. Суммарный ионный ток определяется вероятностью нахождения в открытом состоянии в каждый конкретный период времени определенного числа каналов (рис. 2.3, В).
|
|
|
Рис. 2.3. Метод локальной фиксации потенциала «path-clamp». А — схема метода; Б — форма тока, протекающего через одиночный натриевый канал при действии деполяризующего стимула. 1 — ионные каналы и клеточная мембрана; 2 — стеклянный микроэлектрод; 3 — ионный ток через открытый канал; 4 — токи через одиночный натриевый канал; В — суммарный ток через натриевые каналы (по Patlack A. Horn, 1982). |
Наружная часть канала сравнительно доступна для изучения, исследование внутренней части представляет значительные трудности. П. Г. Костюком был разработан метод внутриклеточного диализа, который позволяет изучать функцию входных и выходных структур ионных каналов без применения микроэлектродов. Оказалось, что часть ионного канала, открытая во внеклеточное пространство, по своим функциональным свойствам отличается от части канала, обращенной во внутриклеточную среду.
Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость.
Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
|
|
|
Рис. 2.4. Работа натриевых каналов и «воротных» механизмов. А — в покое m-активационные ворота («m-ворота») закрыты; Б — при возбуждении «m-ворота» открыты; В — закрытие «n-ворот» (инактивация) при деполяризации. |
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия m-ворот происходит закрытие п-ворот, расположенных у выхода натриевых каналов (инактивация) (рис. 2.4). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула.
Работа натриевых каналов определяется величиной мембранного потенциала в соответствии с определенными законами вероятности. Рассчитано, что активированный натриевый канал пропускает всего 6000 ионов за 1 мс. При этом весьма существенный натриевый ток, который проходит через мембраны во время возбуждения, представляет собой сумму тысяч одиночных токов.
При генерации одиночного потенциала действия в толстом нервном волокне изменение концентрации ионов Na+ во внутренней среде составляет всего 1/100000 от внутреннего содержания ионов Na гигантского аксона кальмара. Однако для тонких нервных волокон это изменение концентрации может быть весьма существенным.
Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов (см. табл. 2.1).
Ходжкин и Хаксли сформулировали принцип «независимости» каналов, согласно которому потоки натрия и калия через мембрану независимы друг от друга.
Свойство проводимости различных каналов неодинаково. В частности, для калиевых каналов процесс инактивации, как для натриевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя.
Особый интерес представляют кальциевые каналы.
Входящий кальциевый ток, как правило, недостаточно велик, чтобы нормально деполяризовать клеточную мембрану. Чаще всего поступающий в клетку кальций выступает в роли «мессенджера», или вторичного посредника. Активация кальциевых каналов обеспечивается деполяризацией клеточной мембраны, например входящим натриевым током.
Процесс инактивации кальциевых каналов достаточно сложен. С одной стороны, повышение внутриклеточной концентрации свободного кальция приводит к инактивации кальциевых каналов. С другой стороны, белки цитоплазмы клеток связывают кальций, что позволяет поддерживать длительное время стабильную величину кальциевого тока, хотя и на низком уровне; при этом натриевый ток полностью подавляется. Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.
2.1.2. Методы изучения возбудимых клеток
Электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран. Поэтому необходимо остановиться на методических подходах современной физиологии возбудимых тканей, используемых при исследовании электрических характеристик клеточных мембран.
Любая физиологическая установка, предназначенная для изучения возбудимых клеток и тканей, должна содержать следующие основные элементы: 1) электроды для регистрации и стимуляции; 2) усилители биоэлектрических сигналов; 3) регистратор; 4) стимулятор; 5) систему для обработки физиологической информации. В зависимости от задач исследования обычно требуется дополнительное оборудование. Поскольку в современной медицине широко используются методы электрофизиологического исследования и воздействия электрическим током, необходимо кратко познакомиться с основными методическими приемами.
При работе на изолированных органах, тканях и отдельных клетках применяют специальные камеры и растворы определенного состава, например Рингера-Локка, Тироде, Хэнкса, позволяющие в течение длительного времени поддерживать нормальную жизнедеятельность биологического объекта. Во время эксперимента раствор должен быть насыщен кислородом и иметь соответствующую температуру (для хладнокровных животных +20°С, для теплокровных +37°С). В процессе эксперимента необходимо использовать проточные камеры для непрерывного обновления раствора, в котором находится биологический объект.
При электрофизиологических исследованиях используют различные типы электродов, детальное описание которых можно найти в соответствующих руководствах. В то же время есть определенные требования ко всем без исключения электродным системам.
Электроды, которые используют в эксперименте, должны оказывать минимальное влияние на объект исследования, т. е. они должны только передавать информацию от объекта или на объект.
Если в электрофизиологическом эксперименте исследуют собственно процесс возбуждения, то необходимо применять два электрода с различной величиной площади контактной поверхности (желательно в соотношении не менее 1:100), при этом электрод меньшей площади называют активным, или референтным, большей площади — пассивным, или индифферентным. При исследовании процесса распространения возбуждения необходимо использовать два активиых электрода с одинаковой площадью контактных поверхностей, устанавливаемых на возбудимой ткани на некотором расстоянии друг от друга, и индифферентный электрод, который устанавливается в отдалении. В первом случае говорят о моно-(уни-) полярном способе отведения потенциала (раздражении), во втором — о биполярном способе. Необходимо подчеркнуть, что термин «униполярный» способ весьма условен, поскольку всегда регистрируется разность потенциалов, а не абсолютное значение потенциала.
Поскольку работа с биологическим объектом подразумевает контакт электрода с жидкостью, содержащейся в биологическом объекте, высока вероятность возникновения контактных поляризационных потенциалов, которые могут существенно исказить результаты исследования. Чтобы избежать возможных искажений в электрофизиологических экспериментах, как правило, используют специальные слабополяризующиеся электроды, например хлорсеребряные или каломельные, имеющие незначительный поляризационный потенциал.
При исследовании электрофизиологических характеристик отдельных клеток используют стеклянные микроэлектроды. Они представляют собой микропипетку с диаметром кончика менее 0,5 мкм, заполненные ЗМ раствором хлорида калия.
В электрофизиологических экспериментах применяют самые различные усилители биологических сигналов, позволяющие измерять минимальные изменения тока (до 10 А) и напряжения (до 10 -7 В) В связи с тем что регистрируемые сигналы могут иметь высокую скорость нарастания переднего фронта, усилители должны иметь достаточно широкую полосу пропускания (сотни кГц). Наибольшие требования предъявляются ко входным каскадам усилителей, которые должны быть согласованы с внутренним сопротивлением измерительного электрода, причем наибольшие трудности экспериментатор встречает при использовании микроэлектродов для регистрации быстрых изменений тока или потенциала, поскольку микроэлектроды могут иметь очень высокое внутреннее сопротивление (до 150 мОм).
Стимулвторы, регистраторы, системы управления экспериментом и обработки физиологической информации еще более разнообразны и их описание можно найти в специальной литературе.
|
|
|
Рис. 2.5. Внутриклеточная регистрация трансмембранных потенциалов и электростимуляция клеточной мембраны. К — схема установки для изучения электрических характеристик клеточных мембран; Б — момент введения микроэлектрода а клетку. 1 — стеклянный микроэлектрод для подачи тока; 2 — стеклянный микроэлектрод для регистрации реакции клеточной мембраны; 3 — электроды сравнения; 4 — измеритель величины раздражающего тока; 5 — усилитель; 6 — регистратор. |
На рис. 2.5, А показана схема простейшей установки для измерения трансмембранной разности потенциалов и изучения реакций возбудимой мембраны при ее электрической стимуляции.
Исследуемый биообъект (клетка, кусочек ткани) помещен в камеру, содержащую солевой раствор и электрод сравнения. Если измерительный электрод также находится в растворе, то разность потенциалов между ним и электродом сравнения стремится к нулю. В момент проникновения микроэлектрода внутрь клетки регистрируют отрицательный потенциал относительно внешней среды (рис. 2.5, Б). Перемещение кончика микроэлектрода внутри клетки не приводит к изменению измеряемой разности потенциалов, если электрод не повредил клетку. У покоящейся клетки с нормальным метаболизмом и стабильными условиями внешней и внутренней среды постоянная разность потенциалов будет регистрироваться неопределенно долго. Эта постоянная разность потенциалов называется потенциалом покоя, или мембранным потенциалом покоя. При этом потенциал внеклеточной среды принимается равным нулю. Величина потенциала покоя неодинакова у различных типов клеток и колеблется обычно от -70 до -95 мВ.
В том случае, если в клетку введен второй, стимулирующий микроэлектрод, можно исследовать реакцию возбудимой мембраны на действие электрического тока. Если стимулирующий электрод электроотрицателен по отношению к внутренней среде клетки, то говорят о входящем токе, при этом общая трансмембранная разность потенциалов увеличивается, т. е. происходит гиперполяризация клеточной мембраны. Напротив, если стимулирующий электрод электроположителен по отношению к внутренней среде клетки, то говорят о выходящем токе, при этом общая трансмембранная разность потенциалов уменьшается, т. е. происходит деполяризация клеточной мембраны (рис. 2.6). Как правило, при действии гиперполяризующего тока потенциал мембраны изменяется в соответствии с законом Ома. При этом изменение потенциала не зависит от молекулярных процессов в мембране, поэтому говорят, что изменяются пассивные электрические свойства мембраны. При действии деполяризующего тока потенциал мембраны не подчиняется закону Ома, что связано с изменением функциональных характеристик ионных каналов клеточной мембраны. Если деполяризация клеточной мембраны достигает так называемого критического уровня, происходит активация ионных каналов клеточной мембраны и возникает потенциал действия. Критический потенциал (Eкp) — уровень мембранного потенциала, при котором начинается генерация потенциала действия. Потенциал действия (ПД, спайк, импульс) — быстрое колебание мембранного потенциала покоя в положительном направлении. В этом случае мембрана реагирует активно, поскольку изменение трансмембранной разности потенциалов обусловлено изменением функциональных свойств ионных каналов.
Детальный анализ процессов, протекающих в мембранах возбудимых клеток, был проведен Ходжкиным, Хаксли и Катцем в опытах на гигантском аксоне кальмара и привел к созданию современной теории происхождения потенциала покоя и потенциала действия.
|
|
|
Рис. 2.6. Реакция возбудимой мембраны на действие деполяризующего и гиперполяризующего токов. А — реакция клеточной мембраны на гиперполяризуюший (I, 2) и деполяризующий (3, 4) ток; Б — величина и направление гиперполяриэующего 1',2') и деполяризующего (3' ,4' ) стимулирующего тока. |
Схема опыта Ходжкина—Хаксли приведена на рис. 2.7. В аксон кальмара диаметром около 1 мм, помещенный в морскую воду, вводили активный электрод, второй электрод (электрод сравнения) находился в морской воде. В момент введения электрода внутрь аксона регистрировали скачок отрицательного потенциала, т. е. внутренняя среда аксона была заряжена отрицательно относительно внешней среды.
|
|
|
Рис. 2.7. Опыт Ходжкина—Хаксли на гигантском аксоне кальмара. А — стимуляция аксона электрическим стимулом прямоугольной формы; Б — форма потенциала действия, зарегистрированная в данном опыте. 1 — аксон; 2 — активный электрод; 3 — электрод сравнения; 4 — усилитель. Стрелками показано направление распространения возбуждения. |
Как указывалось в разделе 2.1.2, электрический потенциал содержимого живых клеток принято измерять относительно потенциала внешней среды, который обычно принимают равным нулю. Поэтому считают синонимами такие понятия, как трансмембранная разность потенциалов в покое, потенциал покоя, мембранный потенциал. Обычно величина потенциала покоя колеблется от -70 до -95 мВ. Согласно концепции Ходжкина и Хаксли, величина потенциала покоя зависит от ряда факторов, в частности от селективной (избирательной) проницаемости клеточной мембраны для различных ионов; различной концентрации ионов цитоплазмы клетки и ионов окружающей среды (ионной асимметрии); работы механизмов активного транспорта ионов. Все эти факторы тесно связаны между собой и их разделение имеет определенную условность.
Известно, что в невозбужденном состоянии клеточная мембрана высокопроницаема для ионов калия и малопроницаема для ионов натрия. Это было показано в опытах с использованием изотопов натрия и калия: спустя некоторое время после введения внутрь аксона радиоактивного калия его обнаруживали во внешней среде. Таким образом, происходит пассивный (по градиенту концентраций) выход ионов калия из аксона. Добавление радиоактивного натрия во внешнюю среду приводило к незначительному повышению его концентрации внутри аксона. Пассивный вход натрия внутрь аксона несколько уменьшает величину потенциала покоя.
Установлено, что имеется разность концентраций ионов калия вне и внутри клетки, причем внутри клетки ионов калия примерно в 20—50 раз больше, чем вне клетки (табл. 2.2).
Таблица 2.2. Концентрация ионов снаружи и внутри клетки, ммоль/л
|
Ионы |
Аксон кальмара |
Мышечное волокно (лягушка) | ||
|
внутри клетки |
снаружи клетки |
внутри клетки |
снаружи клетки | |
|
к+ |
397 |
20 |
124 |
2.2 |
|
Na+ |
50 |
437 |
4 |
109 |
|
Сl- |
40 |
556 |
1.5 |
77 |
Разность концентраций ионов калия вне и внутри клетки и высокая проницаемость клеточной мембраны для ионов калия обеспечивают диффузионный ток этих ионов из клетки наружу и накопление избытка положительных ионов К+ на наружной стороне клеточной мембраны, что противодействует дальнейшему выходу ионов К+ из клетки. Диффузионный ток ионов калия существует до тех пор, пока стремление их двигаться по концентрационному градиенту не уравновесится разностью потенциалов на мембране. Эта разность потенциалов называется калиевым равновесным потенциалом.
Равновесный потенциал (для соответствующего иона, Ек) — разность потенциалов между внутренней средой клетки и внеклеточной жидкостью, при которой вход и выход иона уравновешен (химическая разность потенциалов равна электрической).
Важно подчеркнуть следующие два момента: 1) состояние равновесия наступает в результате диффузии лишь очень небольшого количества ионов (по сравнению с их общим содержанием); калиевый равновесный потенциал всегда больше (по абсолютному значению) реального потенциала покоя, поскольку мембрана в покое не является идеальным изолятором, в частности имеется небольшая утечка ионов Na+. Сопоставление теоретических расчетов с использованием уравнений постоянного поля Д. Голдмана, формулы Нернста показали хорошее совпадение с экспериментальными данными при изменении вне- и внутриклеточной концентрации К+ (рис. 2.8).
Трансмембранная диффузионная разность потенциалов рассчитывается по формуле Нернста:
Ek=(RT/ZF)ln(Ko/Ki)
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, Z — валентность нона, F — постоянная Фарадея, Ко и Ki — концентрации ионов К+ вне и внутри клетки соответственно.
|
|
|
Рис. 2.8. Зависимость величины потенциала покоя от внеклеточной концентрации К+ (расчетная и экспериментальная кривые). По оси абсцисс – содержание калия во внешней среде в мМ, по оси ординат – величина мембранного потенциала в мВ. |
Величина мембранного потенциала для значений концентрации ионов К+, приведенных в табл. 2.2, при температуре +20 °С составит примерно —60 мВ. Поскольку концентрация ионов К+ вне клетки меньше, чем внутри, Ек будет отрицательным.
В состоянии покоя клеточная мембрана высокопроницаема не только для ионов К+. У мышечных волокон мембрана высокопроницаема для ионов СГ. В клетках с высокой проницаемостью для ионов Сl-, как правило, оба иона (Сl- и К+) практически в одинаковой степени участвуют в создании потенциала покоя.
Известно, что в любой точке электролита количество анионов всегда соответствует количеству катионов (принцип электронейтральности), поэтому внутренняя среда клетки в любой точке электронейтральна. Действительно, в опытах Ходжкина, Хаксли и Катца перемещение электрода внутри аксона не выявило различие в трансмембранной разности потенциалов.
Поскольку мембраны живых клеток в той или иной степени проницаемы для всех ионов, совершенно очевидно, что без специальных механизмов невозможно поддерживать постоянную разность концентрации ионов (ионную асимметрию). В клеточных мембранах существуют специальные системы активного транспорта, работающие с затратой энергии и перемещающие ионы против градиента концентраций. Экспериментальным доказательством существования механизмов активного транспорта служат результаты опытов, в которых активность АТФазы подавляли различными способами, например сердечным гликозидом оуабаином. При этом происходило выравнивание концентраций ионов К+ вне и внутри клетки и мембранный потенциал уменьшался до нуля.
Важнейшим механизмом, поддерживающим низкую внутриклеточную концентрацию ионов Na+ и высокую концентрацию ионов К+, является натрий-калиевый насос (рис. 2.9). Известно, что в клеточной мембране имеется система переносчиков, каждый из которых связывается с 3 находящимися внутри клетки ионами Na+ и выводит их наружу. С наружной стороны переносчик связывается с 2 находящимися вне клетки ионами К+, которые переносятся в цитоплазму. Энергообеспечение работы систем переносчиков обеспечивается АТФ. Функционирование насоса по такой схеме приводит к следующим результатам.
1. Поддерживается высокая концентрация ионов К+ внутри клетки, что обеспечивает постоянство величины потенциала покоя. Вследствие того что за один цикл обмена ионов из клетки выводится на один положительный ион больше, чем вводится, активный транспорт играет роль в создании потенциала покоя. В этом случае говорят об электрогенном насосе. Однако величина вклада электрогенного насоса в общее значение потенциала покоя обычно невелика и составляет несколько милливольт.
2. Поддерживается низкая концентрация ионов натрия внутри клетки, что, с одной стороны, обеспечивает работу механизма генерации потенциала действия, с другой — обеспечивает сохранение нормальных осмолярности и объема клетки.
3. Поддерживая стабильный концентрационный градиент Na+, натрий-калиевый насос способствует сопряженному транспорту аминокислот и сахаров через клеточную мембрану.
Таким образом, возникновение трансмембранной разности потенциалов (потенциала покоя) обусловлено высокой проводимостью клеточной мембраны в состоянии покоя для ионов К+ (для мышечных клеток и ионов Сl-), ионной асимметрией концентраций для ионов К+ (для мышечных клеток и для ионов Cl-), работой систем активного транспорта, которые создают и поддерживают ионную асимметрию.
|
|
|
Рис. 2.9. Участие натрий-калиевого насоса в генерации потенциала покоя. А — внеклеточная среда; Б — внутриклеточная среда. |
Емкость мембраны и работа метаболических ионных насосов приводят к накоплению потенциальной электрической энергии на клеточной мембране в форме потенциала покоя. Эта энергия может освобождаться в виде специфических электрических сигналов (потенциала действия), характерных для возбудимых тканей: нервной, мышечной, некоторых рецепторных и секреторных клеток. Под потенциалом действия понимают быстрое колебание потенциала покоя, сопровождающееся, как правило, перезарядкой мембраны. Форма потенциала действия аксона и терминология, используемая для описания потенциала действия, приведены на рис. 2.10.
Для правильного понимания процессов, происходящих при генерации потенциала действия, используем схему опыта, приведенную на рис. 2.5. Если через стимулирующий электрод подавать короткие толчки гиперполяризующего тока, то можно зарегистрировать увеличение мембранного потенциала, пропорциональное амплитуде подаваемого тока; при этом мембрана проявляет свои емкостные свойства — замедленное нарастание и снижение мембранного потенциала (см. рис. 2.6).
Ситуация будет изменяться, если через стимулирующий электрод подавать короткие толчки деполяризующего тока. При небольшой (подпороговой) величине деполяризующего тока мембрана ответит пассивной деполяризацией и проявит емкостные свойства. Подпороговое пассивное поведение клеточной мембраны называется электротоническим, или электротоном. Увеличение деполяризующего тока приведет к появлению активной реакции клеточной мембраны в форме повышения натриевой проводимости (gNa+). При этом проводимость клеточной мембраны не будет подчиняться закону Ома. Отклонение от пассивного поведения проявляется обычно при 50—80% значении порогового тока. Активные подпороговые изменения мембранного потенциала называются локальным ответом.
|
|
|
Рис. 2.10. Потенциал действия одиночной клетки и его фазы. А — реакция клеточной мембраны на деполяризующий стимул; Б — величина деполяризующего тока; 1 — локальный ответ; 2 — быстрая деполяризация; 3 — реверсия; 4 — реполяриэация; 5 — положительный следовой потенциал. По оси абсцисс — отметка времени. |
Смещение мембранного потенциала до критического уровня приводит к генерации потенциала действия. Минимальное значение тока, необходимого для достижения критического потенциала, называют пороговым током. Следует подчеркнуть, что не существует абсолютных значений величины порогового тока и критического уровня потенциала, поскольку эти параметры зависят от электрических характеристик мембраны и ионного состава окружающей внешней среды, а также от параметров стимула. Зависимость между величиной стимулирующего тока и временем его действия рассматривается в разделе 2.1.5.
В опытах Ходжкина и Хаксли был обнаружен, на первый взгляд, удивительный эффект. Во время генерации потенциала действия мембранный потенциал уменьшался не просто до нуля, как следовало бы из уравнения Нернста, но изменил свой знак на противоположный.
Анализ ионной природы потенциала действия, проведенный первоначально Ходжкиным, Хаксли и Катцем, позволил установить, что фронт нарастания потенциала действия и перезарядка мембраны (овершут) обусловлены движением ионов натрия внутрь клетки. Как уже указывалось выше, натриевые каналы оказались электроуправляемыми. Деполяризующий толчок тока приводит к активации натриевых каналов и увеличению натриевого тока. Это обеспечивает локальный ответ. Смещение мембранного потенциала до критического уровня приводит к стремительной деполяризации клеточной мембраны и обеспечивает фронт нарастания потенциала действия. Если удалить ион Na+ из внешней среды, то потенциал действия не возникает. Аналогичный эффект удавалось получить при добавлении в перфузионный раствор ТТХ (тетродотоксин) — специфического блокатора натриевых каналов (см. табл. 2.1). При использовании метода «voltage-clamp» было показано, что в ответ на действие деполяризующего тока через мембрану протекает кратковременный (1—2 мс) входящий ток, который сменяется через некоторое время выходящим током (рис. 2.11). При замене ионов натрия на другие ионы и вещества, например холин, удалось показать, что входящий ток обеспечивается натриевым током, т. е. в ответ на деполяризующий стимул происходит повышение натриевой проводимости (gNa+). Таким образом, развитие фазы деполяризации потенциала действия обусловлено повышением натриевой проводимости.
Критический потенциал определяет уровень максимальной активации натриевых каналов. Если смещение мембранного потенциала достигает значения критического уровня потенциала, то процесс поступления ионов Na+ в клетку лавинообразно нарастает. Система начинает работать по принципу положительной обратной связи, т. е. возникает регенеративная (самоусиливающаяся) деполяризация.
Перезарядка мембраны, или овершут, весьма характерна для большинства возбудимых клеток. Амплитуда овершута характеризует состояние мембраны и зависит от состава вне- и внутриклеточной среды. На высоте овершута потенциал действия приближается к равновесному натриевому потенциалу, поэтому происходит изменение знака заряда на мембране.
|
|
|
Рис. 2.11. Действие деполяризующего стимула (А), ионные токи (Б) и изменение проводимости клеточной мембраны (В) для ионов Na+ (gNa+, INa+) и K+ (gK+,IK+) во время действия деполяризующего стимула. |
Экспериментально было показано, что амплитуда потенциала действия практически не зависит от силы стимула, если он превышает пороговую величину. Поэтому принято говорить, что потенциал действия подчиняется закону "все или ничего".
На пике потенциала действия проводимость мембраны для ионов натрия (gNa+) начинает быстро снижаться. Этот процесс называется инактивацией. Скорость и степень натриевой инактивации зависят от величины мембранного потенциала, т. е. они потенциалзависимы. При постепенном уменьшении мембранного потенциала до —50 мВ (например, при дефиците кислорода, действии некоторых лекарственных веществ) система натриевых каналов полностью инактивируется и клетка становится невозбудимой.
Потенциалзависнмость активации и инактивации в большой степени обусловлена концентрацией ионов кальция. При повышении концентрации кальция значение порогового потенциала увеличивается, при понижении — уменьшается и приближается к потенциалу покоя. При этом в первом случае возбудимость уменьшается, во втором — увеличивается.
После достижения пика потенциала действия происходит реполяризациа, т. е. мембранный потенциал возвращается к контрольному значению в покое. Рассмотрим эти процессы подробнее. Развитие потенциала действия и перезарядка мембраны приводят к тому, что внутриклеточный потенциал становится еще более положительным, чем равновесный калиевый потенциал, и, следовательно, электрические силы, перемещающие ионы калия через мембрану, увеличиваются. Максимума эти силы достигают во время пика потенциала действия. Кроме тока, обусловленного пассивным передвижением ионов калия, был обнаружен задержанный выходящий ток, который также переносился ионами К+, что было показано в опытах с применением изотопа К+. Этот ток достигает максимума спустя 5—8 мс от начала генерации потенциала действия. Введение тетраэтиламмония (ТЭА) — блокатора калиевых каналов — замедляет процесс реполяризации. В обычных условиях задержанный выходящий калиевый ток существует некоторое время после генерации потенциала действия и это обеспечивает гиперполяризацию клеточной мембраны, т. е. положительный следовой потенциал. Положительный следовой потенциал может возникать и как следствие работы натриево-электрогенного насоса. На рис. 2.12 показано изменение проводимости клеточной мембраны для ионов натрия и калия в различные фазы потенциала действия.
Инактивация натриевой системы в процессе генерации потенциала действия приводит к тому, что клетка в этот период не может быть повторно возбуждена, т. е. наблюдается состояние абсолютной рефрактерности.
Постепенное восстановление потенциала покоя в процессе реполяризации дает возможность вызвать повторный потенциал действия, но для этого требуется сверхпороговый стимул, так как клетка находится в состоянии относительной рефрактерности.
Исследование возбудимости клетки во время локального ответа или во время отрицательного следового потенциала показало, что генерация потенциала действия возможна при действии стимула ниже порогового значения. Это состояние супернормальности, или экзальтации. На рис. 2.13 показано изменение возбудимости во время генерации потенциала действия.
Продолжительность периода абсолютной рефрактерности ограничивает максимальную частоту генерации потенциалов действия данным типом клеток. Например, при продолжительности периода абсолютной рефрактерности 4 мс максимальная частота равна 250 Гц.
|
|
|
Рис. 2.12. Потенциал действия (А) и изменение проводимости клеточной мембраны (Б) для Na+ (gNa+) и К+ (gK+) во время генерации потенциала действия; Екр — критический потенциал, Еm — мембранный потенциал; h — показатель способности натриевых каналов к активации. |
Н. Е. Введенский ввел понятие лабильности, или функциональной подвижности, возбудимых тканей. Мерой лабильности является количество потенциалов действия, которое способна генерировать возбудимая ткань в единицу времени. Очевидно, что лабильность возбудимой ткани в первую очередь определяется продолжительностью периода рефрактерности. Наиболее лабильными являются волокна слухового нерва, в которых частота генерации потенциалов действия достигает 1000 Гц.
|
|
|
Рис. 2.13. Фазовые изменения возбудимости при генерации потенциала действия (по Б. И. Ходорову). А — потенциал действия; Б — изменение возбудимости. |
Таким образом, генерация потенциала действия в возбудимых мембранах возникает под влиянием различных факторов и сопровождается повышением проводимости клеточной мембраны для ионов натрия, входом их внутрь клетки, что приводит к деполяризации клеточной мембраны и появлению локального ответа. Этот процесс может достигнуть критического уровня деполяризации, после чего проводимость мембраны для натрия увеличивается до максимума, мембранный потенциал при этом приближается к натриевому равновесному потенциалу. Через несколько миллисекунд происходит инактивация натриевых каналов, активация калиевых каналов, увеличение выходящего калиевого тока, что приводит к реполяризации и восстановлению исходного потенциала покоя.
2.1.5. Действие электрического тока на возбудимые ткани
Электрический ток широко используется в экспериментальной физиологии при изучении характеристик возбудимых тканей, в клинической практике для диагностики и лечебного воздействия, поэтому необходимо рассмотреть механизмы воздействия электрического тока на возбудимые ткани. Реакция возбудимой ткани зависит от формы тока (постоянный, переменный или импульсный), продолжительности действия тока, крутизны нарастания (изменения) амплитуды тока.
Эффект воздействия определяется не только абсолютным значением тока, но и плотностью тока под стимулирующим электродом. Плотность тока определяется отношением величины тока, протекающего по цепи, к величине площади электрода, поэтому при монополярном раздражении площадь активного электрода всегда меньше пассивного.
Постоянный ток. При кратковременном пропускании подпорогового постоянного электрического тока изменяется возбудимость ткани под стимулирующими электродами. Микроэлектродные исследования показали, что под катодом происходит деполяризация клеточной мембраны, под анодом—гиперполяризация (рис. 2.14, А). В первом случае будет уменьшаться разность между критическим потенциалом и мембранным потенциалом, т. е. возбудимость ткани под катодом увеличивается. Под анодом происходят противоположные явления (рис. 2.14, Г), т. е. возбудимость уменьшается. Если мембрана отвечает пассивным сдвигом потенциала, то говорят об электротонических сдвигах, или электротоне. При кратковременных электротонических сдвигах значение критического потенциала не изменяется.
Поскольку практически у всех возбудимых клеток длина клетки превышает ее диаметр, электротонические потенциалы распределяются неравномерно. В точке локализации стимулирующего электрода сдвиг потенциала происходит очень быстро и временные параметры определяются величиной емкости мембраны. В удаленных участках мембраны ток проходит не только через мембрану, но и преодолевает продольное сопротивление внутренней среды. Электротонический потенциал падает экспоненциально с увеличением длины, а расстояние, на котором он падает в 1/е раз (до 37%), называют константой длины (λ).
При сравнительно большой продолжительности действия подпорогового тока изменяется не только мембранный потенциал, но и значение критического потенциала. При этом под катодом происходит смещение уровня критического потенциала вверх (рис. 2.14, Б), что свидетельствует об инактивации натриевых каналов. Таким образом, возбудимость под катодом уменьшается при длительном воздействии подпорогового тока. Это явление уменьшения возбудимости при длительном действии подпорогового раздражителя называется аккомодацией. При этом в исследуемых клетках возникают аномально низкоамплитудные потенциалы действия.
|
|
|
Рис. 2.14. Действие электрического тока на возбудимые ткани. А — изменение мембранного потенциала под катодом при кратковременном пропускании тока; Б — изменение мембранного потенциала и критического потенциала под катодом при длительном пропускании тока; В — возникновение потенциала действия при пороговом значении тока; Г — изменение мембранного потенциала под анодом при кратковременном пропускании тока; Д — изменение мембранного потенциала и критического потенциала при длительном действии сильного анодного тока — анодно-размыкательное возбуждение. По оси ординат — величина мембранного потенциала (Екр — критический потенциал) а мВ и величина стимула в относительных единицах (от величины порога). Стрелками показана величина порога возбудимости. |
Скорость нарастания интенсивности раздражителя имеет существенное значение при определении возбудимой ткани, поэтому чаще всего используют импульсы прямоугольной формы (импульс тока прямоугольной формы имеет максимальную крутизну нарастания). Замедление скорости изменения амплитуды раздражителя приводит к тому, что происходит инактивация натриевых каналов вследствие постепенной деполяризации клеточной мембраны, а следовательно, к падению возбудимости.
Увеличение силы стимула до порогового значения приводит к генерации потенциала действия (рис. 2.14, В).
Под анодом при действии сильного тока происходит изменение уровня критического потенциала, в противоположном направлении — вниз (рис. 2.14, Д). При этом уменьшается разность между критическим потенциалом и мембранным потенциалом, т. е. возбудимость под анодом при длительном действии тока повышается.
Очевидно, что увеличение значения тока до пороговой величины приведет к тому, что возбуждение будет возникать под катодом при замыкании цепи. Следует подчеркнуть, что этот эффект может быть выявлен в случае продолжительного действия электрического тока. При действии достаточно сильного тока смещение критического потенциала под анодом может быть весьма существенным и достигать первоначального значения мембранного потенциала. Выключение тока приведет к тому, что гиперполяризация мембраны исчезнет, мембранный потенциал вернется к первоначальному значению, а это соответствует величине критического потенциала, т. е. возникает анодно-размыкательное возбуждение.
Изменение возбудимости и возникновение возбуждения под катодом при замыкании и анодом при размыкании носит название закона полярного действия тока. Экспериментальное подтверждение этой зависимости впервые было получено Пфлюгером еще в прошлом веке.
Как указывалось выше, существует определенное соотношение между временем действия раздражителя и его амплитудой. Эта зависимость в графическом выражении получила название кривой «сила—длительность» (рис. 2.15). Иногда по имени авторов ее называют кривой Гоорвега—Вейса—Лапика. На этой кривой видно, что уменьшение значения тока ниже определенной критической величины не приводит к возбуждению ткани независимо от продолжительности времени, в течение которого действует этот раздражитель, а минимальная величина тока, вызывающая возбуждение, получила название порога раздражения, или реобазы. Величина реобазы определяется разностью между критическим потенциалом и мембранным потенциалом покоя.
С другой стороны, раздражитель должен действовать не меньше определенного времени. Уменьшение времени действия раздражителя ниже критического значения приводит к тому, что раздражитель любой интенсивности не оказывает эффекта. Для характеристики возбудимости ткани по времени ввели понятие порога времени — минимальное (полезное) время, в течение которого должен действовать раздражитель пороговой силы с тем, чтобы вызвать возбуждение (отрезок АС на рис. 2.15).
Порог времени определяется емкостной и резистивной характеристикой клеточной мембраны, т. е. постоянной временя T=RC.
В связи с тем что величина реобазы может изменяться, особенно в естественных условиях, и это может привести к значительной погрешности в определении порога времени, Лапик ввел понятие хронаксии для характеристики временных свойств клеточных мембран. Хронаксия — время, в течение которого должен действовать раздражитель удвоенной реобазы, чтобы вызвать возбуждение. Использование этого критерия позволяет точно измерить временные характеристики возбудимых структур, поскольку измерение происходит на крутом изгибе гиперболы (отрезок AD на рис. 2.15).
Хронаксиметрия используется при оценке функционального состояния нервно-мышечной системы у человека. При ее органических поражениях величина хронаксии и реобазы нервов и мышц значительно возрастает.
Таким образом, при оценке степени возбудимости возбудимых структур используют количественные характеристики раздражителя — амплитуду, продолжительность действия, скорость нарастания амплитуды. Следовательно, количественная оценка физиологических свойств возбудимой ткани производится опосредованно по характеристикам раздражителя.
|
|
|
Рис. 2.15. Кривая "сила — длительность". АВ — реобаза; АС — порог времени; АЕ — двойная реобаза; АD — хронаксия. По оси абсцисс — продолжительность действия стимула, по оси ординат — величина реобазы. |
Переменный ток. Эффективность действия переменного тока определяется не только амплитудой, продолжительностью воздействия, но и частотой. При этом низкочастотный переменный ток, например частотой 50 Гц (сетевой), представляет наибольшую опасность при прохождении через область сердца. В первую очередь это обусловлено тем, что при низких частотах возможно попадание очередного стимула в фазу повышенной уязвимости миокарда (см. главу 7) и возникновение фибрилляции желудочков сердца. Действие тока частотой выше 10 кГц представляет меньшую опасность, поскольку длительность полупериода составляет 0,05 мс. При такой длительности импульса мембрана клеток вследствие своих емкостных свойств не успевает деполяризоваться до критического уровня. Токи большей частоты вызывают, как правило, тепловой эффект.
2.2.1. Строение и морфофункциональная классификация нейронов
Структурной и функциональной единицей нервной системы является нервная клетка — нейрон.
Нейроны — специализированные клетки, способные принимать, обрабатывать, кодировать, передавать и хранить информацию, организовывать реакции на раздражения, устанавливать контакты с другими нейронами, клетками органов. Уникальными особенностями нейрона являются способность генерировать электрические разряды и передавать информацию с помощью специализированных окончаний — синапсов.
Выполнению функций нейрона способствует синтез в его аксоплазме веществ-передатчиков — нейромедиаторов (нейротрансмиттеры): ацетилхолина, катехоламинов и др. Размеры нейронов колеблются от 6 до 120 мкм.
Число нейронов мозга человека приближается к 1011. На одном нейроне может быть до 10 000 синапсов. Если только эти элементы считать ячейками хранения информации, то можно прийти к выводу, что нервная система может хранить 1019 ед. информации, т. е. способна вместить практически все знания, накопленные человечеством. Поэтому вполне обоснованным является представление, что человеческий мозг в течение жизни запоминает все происходящее в организме и при его общении со средой. Однако мозг не может извлекать из памяти всю информацию, которая в нем хранится.
Для различных структур мозга характерны определенные типы нейронной организации. Нейроны, организующие единую функцию, образуют так называемые группы, популяции, ансамбли, колонки, ядра. В коре большого мозга, мозжечке нейроны формируют слои клеток. Каждый слой имеет свою специфическую функцию.
Клеточные скопления образуют серое вещество мозга. Между ядрами, группами клеток и между отдельными клетками проходят миелинизированные или немиелинизированные волокна: аксоны и дендриты.
Одно нервное волокно из нижележащих структур мозга в коре разветвляется на нейроны, занимающие объем 0,1 мм3, т. е. одно нервное волокно может возбудить до 5000 нейронов. В постнатальном развитии происходят определенные изменения в плотности расположения нейронов, их объема, ветвления дендритов.
Строение нейрона. Функционально в нейроне выделяют следующие части: воспринимающую — дендриты, мембрана сомы нейрона; интегративную — сома с аксонным холмиком; передающую — аксонный холмик с аксоном.
Тело нейрона (сома), помимо информационной, выполняет трофическую функцию относительно своих отростков и их синапсов. Перерезка аксона или дендрита ведет к гибели отростков, лежащих дистальней перерезки, а следовательно, и синапсов этих отростков. Сома обеспечивает также рост дендритов и аксона.
Сома нейрона заключена в многослойную мембрану, обеспечивающую формирование и распространение электротонического потенциала к аксонному холмику.
Нейроны способны выполнять свою информационную функцию в основном благодаря тому, что их мембрана обладает особыми свойствами. Мембрана нейрона имеет толщину 6 нм и состоит из двух слоев липидных молекул, которые своими гидрофильными концами обращены в сторону водной фазы: один слой молекул обращен внутрь, другой — кнаружи клетки. Гидрофобные концы повернуты друг к другу — внутрь мембраны. Белки мембраны встроены в двойной липидный слой и выполняют несколько функций: белки-"насосы" обеспечивают перемещение ионов и молекул против градиента концентрации в клетке; белки, встроенные в каналы, обеспечивают избирательную проницаемость мембраны; рецепторные белки распознают нужные молекулы и фиксируют их на мембране; ферменты, располагаясь на мембране, облегчают протекание химических реакций на поверхности нейрона. В ряде случаев один и тот же белок может быть и рецептором, и ферментом, и «насосом».
Рибосомы располагаются, как правило, вблизи ядра и осуществляют синтез белка на матрицах тРНК. Рибосомы нейронов вступают в контакт с эндоплазматической сетью пластинчатого комплекса и образуют базофильное вещество.
Базофильное вещество (вещество Ниссля, тигроидное вещество, тигроид) — трубчатая структура, покрытая мелкими зернами, со держит РНК и участвует в синтезе белковых компонентов клетки. Длительное возбуждение нейрона приводит к исчезновению в клетке базофильного вещества, а значит, и к прекращению синтеза специфического белка. У новорожденных нейроны лобной доли коры большого мозга не имеют базофильного вещества. В то же время в структурах, обеспечивающих жизненно важные рефлексы — спин ном мозге, стволе мозга, нейроны содержат большое количество базофильного вещества. Оно аксоплазматическим током из сомы клетки перемещается в аксон.
Пластинчатый комплекс (аппарат Гольджи) — органелла нейрона, окружающая ядро в виде сети. Пластинчатый комплекс участвует в синтезе нейросекреторных и других биологически активных соединений клетки.
Лизосомы и их ферменты обеспечивают в нейроне гидролиз ряда веществ.
Пигменты нейронов — меланин и липофусцин находятся в нейронах черного вещества среднего мозга, в ядрах блуждающего нерва, клетках симпатической системы.
Митохондрии — органеллы, обеспечивающие энергетические потребности нейрона. Они играют важную роль в клеточном дыхании. Их больше всего у наиболее активных частей нейрона: аксонного холмика, в области синапсов. При активной деятельности нейрона количество митохондрий возрастает.
Нейротрубочки пронизывают сому нейрона и принимают участие в хранении и передаче информации.
Ядро нейрона окружено пористой двухслойной мембраной. Через поры происходит обмен между нуклеоплазмой и цитоплазмой. При активации нейрона ядро за счет выпячиваний увеличивает свою поверхность, что усиливает ядерно-плазматические отношения, стимулирующие функции нервной клетки. Ядро нейрона содержит генетический материал. Генетический аппарат обеспечивает дифференцировку, конечную форму клетки, а также типичные для данной клетки связи. Другой существенной функцией ядра является регуляция синтеза белка нейрона в течение всей его жизни.
Ядрышко содержит большое количество РНК, покрыто тонким слоем ДНК.
Существует определенная зависимость между развитием в онтогенезе ядрышка и базофильного вещества и формированием первичных поведенческих реакций у человека. Это обусловлено тем, что активность нейронов, установление контактов с другими нейронами зависят от накопления в них базофильного вещества.
Дендриты — основное воспринимающее поле нейрона. Мембрана дендрита и синаптической части тела клетки способна реагировать на медиаторы, выделяемые аксонными окончаниями изменением электрического потенциала.
Обычно нейрон имеет несколько ветвящихся дендритов. Необходимость такого ветвления обусловлена тем, что нейрон как ин формационная структура должен иметь большое количество входов. Информация к нему поступает от других нейронов через специализированные контакты, так называемые шипики.
«Шипики» имеют сложную структуру и обеспечивают восприятие сигналов нейроном. Чем сложнее функция нервной системы, чем больше разных анализаторов посылают информацию к данной структуре, тем больше «шипиков» на дендритах нейронов. Максимальное количество их содержится на пирамидных нейронах двигательной зоны коры большого мозга и достигает нескольких тысяч. Они занимают до 43% поверхности мембраны сомы и дендритов. За счет «шипиков» воспринимающая поверхность нейрона значительно возрастает и может достигать, например у клеток Пуркинье, 250 000 мкм .
Напомним, что двигательные пирамидные нейроны получают информацию практически от всех сенсорных систем, ряда подкорковых образований, от ассоциативных систем мозга. Если данный «шипик» или группа «шипиков» длительное время перестает получать информацию, то эти «шипики» исчезают.
Аксон представляет собой вырост цитоплазмы, приспособленный для проведения информации, собранной дендритами, переработанной в нейроне и переданной аксону через аксонный холмик — место выхода аксона из нейрона. Аксон данной клетки имеет постоянный диаметр, в большинстве случаев одет в миелиновую оболочку, образованную из глии. Аксон имеет разветвленные окончания. В окончаниях находятся митохондрии и секреторные образования.
Типы нейронов. Строение нейронов в значительной мере соответствует их функциональному назначению. По строению нейроны делят на три типа: униполярные, биполярные и мультиполярные.
Истинно униполярные нейроны находятся только в мезэнцефалическом ядре тройничного нерва. Эти нейроны обеспечивают проприоцептивную чувствительность жевательных мышц.
Другие униполярные нейроны называют псевдоуниполярными, на самом деле они имеют два отростка (один идет с периферии от рецепторов, другой — в структуры центральной нервной системы). Оба отростка сливаются вблизи тела клетки в единый отросток. Все эти клетки располагаются в сенсорных узлах: спинальных, тройничном и т. д. Они обеспечивают восприятие болевой, температурной, тактильной, проприоцептивной, бароцептивной, вибрационной сигнализации.
Биполярные нейроны имеют один аксон и один дендрит. Нейроны этого типа встречаются в основном в периферических частях зрительной, слуховой и обонятельной систем. Биполярные нейроны дендритом связаны с рецептором, аксоном — с нейроном следующего уровня организации соответствующей сенсорной системы.
Мультиполярные нейроны имеют несколько дендритов и один аксон. В настоящее время насчитывают до 60 различных вариантов строения мультиполярных нейронов, однако все они представляют разновидности веретенообразных, звездчатых, корзинчатых и пирамидных клеток.
Обмен веществ в нейроне. Необходимые питательные вещества и соли доставляются в нервную клетку в виде водных растворов. Продукты метаболизма также удаляются из нейрона в виде водных растворов.
Белки нейронов служат для пластических и информационных целей. В ядре нейрона содержится ДНК, в цитоплазме преобладает РНК. РНК сосредоточена преимущественно в базофильном веществе. Интенсивность обмена белков в ядре выше, чем в цитоплазме. Скорость обновления белков в филогенетически более новых структурах нервной системы выше, чем в более старых. Наибольшая скорость обмена белков в сером веществе коры большого мозга. Меньше — в мозжечке, наименьшая — в спинном мозге.
Липиды нейронов служат энергетическим и пластическим материалом. Присутствие в миелиновой оболочке липидов обусловливает их высокое электрическое сопротивление, достигающее у некоторых нейронов 1000 Ом/см2 поверхности. Обмен липидов в нервной клетке происходит медленно; возбуждение нейрона приводит к уменьшению количества липидов. Обычно после длительной умственной работы, при утомлении количество фосфолипидов в клетке уменьшается.
Углеводы нейронов являются основным источником энергии для них. Глюкоза, поступая в нервную клетку, превращается в гликоген, который при необходимости под влиянием ферментов самой клетки превращается вновь в глюкозу. Вследствие того что запасы гликогена при работе нейрона не обеспечивают полностью его энергетические траты, источником энергии для нервной клетки служит глюкоза крови.
Глюкоза расщепляется в нейроне аэробным и анаэробным путем. Расщепление идет преимущественно аэробным путем, этим объясняется высокая чувствительность нервных клеток к недостатку кислорода. Увеличение в крови адреналина, активная деятельность организма приводят к увеличению потребления углеводов. При нар козе потребление углеводов снижается.
В нервной ткани содержатся соли калия, натрия, кальция, магния и др. Среди катионов преобладают К+, Na+, Mg2+, Са2+; из анионов — Сl-, НСОз. Кроме того, в нейроне имеются различные микроэлементы (например, медь и марганец). Благодаря высокой биологической активности они активируют ферменты. Количество микроэлементов в нейроне зависит от его функционального состояния. Так, при рефлекторном или кофеиновом возбуждении содержание меди, марганца в нейроне резко снижается.
Обмен энергии в нейроне в состоянии покоя и возбуждения различен. Об этом свидетельствует значение дыхательного коэффициента в клетке. В состоянии покоя он равен 0,8, а при возбуждении — 1,0. При возбуждении потребление кислорода возрастает на 100%. После возбуждения количество нуклеиновых кислот в цитоплазме нейронов иногда уменьшается в 5 раз.
Собственные энергетические процессы нейрона (его сомы) тесно связаны с трофическими влияниями нейронов, что сказывается прежде всего на аксонах и дендритах. В то же время нервные окончания аксонов оказывают трофические влияния на мышцу или клетки других органов. Так, нарушение иннервации мышцы приводит к ее атрофии, усилению распада белков, гибели мышечных волокон.
Классификация нейронов. Существует классификация нейронов, учитывающая химическую структуру выделяемых в окончаниях их аксонов веществ: холинергические, пептидергические, норадреналинергические, дофаминергические, серотонинергические и др.
По чувствительности к действию раздражителей нейроны делят на моно-, би-, полисенсорные.
Моносенсорные нейроны. Располагаются чаще в первичных проекционных зонах коры и реагируют только на сигналы своей сенсорности. Например, значительная часть нейронов первичной зоны зрительной области коры большого мозга реагирует только на световое раздражение сетчатки глаза.
Моносенсорные нейроны подразделяют функционально по их чувствительности к разным качествам одного раздражителя. Так, отдельные нейроны слуховой зоны коры большого мозга могут реагировать на предъявления тона 1000 Гц и не реагировать на тоны другой частоты. Они называются мономодальными. Нейроны, реагирующие на два разных тона, называются бимодальными, на три и более — полимодальными.
Бисенсорные нейроны. Чаще располагаются во вторичных зонах коры какого-либо анализатора и могут реагировать на сигналы как своей, так и другой сенсорности. Например, нейроны вторичной зоны зрительной области коры большого мозга реагируют на зри тельные и слуховые раздражения.
Полисенсорные нейроны. Это чаще всего нейроны ассоциативных зон мозга; они способны реагировать на раздражение слуховой, зрительной, кожной и других рецептивных систем.
Нервные клетки разных отделов нервной системы могут быть активными вне воздействия — фоновые, или фоновоактивные (рис. 2.16). Другие нейроны проявляют импульсную активность только в ответ на какое-либо раздражение.
Фоновоактивные нейроны делятся на тормозящиеся — урежающие частоту разрядов и возбуждающиеся — учащающие частоту разрядов в ответ на какое-либо раздражение. Фоновоактивные нейроны могут генерировать импульсы непрерывно с некоторым замедлением или увеличением частоты разрядов — это первый тип активности — непрерывно-аритмичный. Такие нейроны обеспечивают тонус нервных центров. Фоновоактивные нейроны имеют большое значение в поддержании уровня возбуждения коры и других структур мозга. Число фоновоактивных нейронов увеличивается в состоянии бодрствования.
Нейроны второго типа выдают группу импульсов с коротким межимпульсным интервалом, после этого наступает период молчания и вновь возникает группа, или пачка, импульсов. Этот тип активности называется пачечным. Значение пачечного типа активности заключается в создании условий проведения сигналов при снижении функциональных возможностей проводящих или воспринимающих структур мозга. Межимпульсные интервалы в пачке равны приблизительно 1— 3 мс, между пачками этот интервал составляет 15—120 мс.
Третья форма фоновой активности — групповая. Групповой тип активности характеризуется апериодическим появлением в фоне группы импульсов (межимпульсные интервалы составляют от 3 до 30 мс), сменяющихся периодом молчания.
Функционально нейроны можно также разделить на три типа: афферентные, интернейроны (вставочные), эфферентные. Первые выполняют функцию получения и передачи информации в вышележащие структуры ЦНС, вторые — обеспечивают взаимодействие между нейронами ЦНС, третьи — передают информацию в нижележащие структуры ЦНС, в нервные узлы, лежащие за пределами ЦНС, и в органы организма.
Функции афферентных нейронов тесно связаны с функциями рецепторов.
|
|
|
Рис. 2.16 Типы фоновой активности и реакций нейронов А — пачечные; Б — групповые; В — тонические нейроны; Г — возбуждающийся; Д — тормозящийся; Е — нереагирующий нейрон. 1 — отметка времени. Стрелкой отмечен момент нанесения раздражения. |
2.2.2. Рецепторы. Рецепторный и генераторный потенциалы
Рецепторы представляют собой специализированные образования, воспринимающие определенные виды раздражений.
Рецепторы обладают наибольшей чувствительностью к адекватным для них раздражениям. Рецепторы делят на четыре группы: механо-, термо-, хемо- и фоторецепторы. Каждую группу подразделяют на более узкие диапазоны рецепции. Например, зрительные рецепторы делятся на воспринимающие освещенность, цвет, слуховые — определенный тон, вкусовые — определенные вкусовые раздражения (соленое, сладкое, горькое) и т. д.
Рецепторный потенциал возникает при раздражении рецептора как результат деполяризации и повышения проводимости участка его мембраны, который называется рецептивным. Рецептивный участок мембраны имеет специфические свойства, в том числе биохимические, отличающие его от мембраны тела и аксона.
Возникший в рецептивных участках мембраны рецепторный потенциал электротонически распространяется на аксонный холмик рецепторного нейрона, где возникает генераторный потенциал. Возникновение генераторного потенциала в области аксонного холмика объясняется тем, что этот участок нейрона имеет более низкие пороги возбуждения и потенциал действия в нем развивается раньше, чем в других частях мембраны нейрона. Чем выше генераторный потенциал, тем интенсивнее частота разрядов распространяющегося потенциала действия от аксона к другим отделам нервной системы. Следовательно, частота разрядов рецепторного нейрона зависит от амплитуды генераторного потенциала.
Рецепторные нейроны различаются по скорости уменьшения их реакции (адаптации) на длящуюся стимуляцию. Рецепторные нейроны, медленно адаптирующиеся к раздражению, т. е. длительное время генерирующие потенциалы действия, называются тоническими. Рецепторы, быстро и коротко реагирующие на стимуляцию группой импульсов, называются физическими.
Таким образом, реакция рецепторного нейрона, предназначенного для передачи информации из области восприятия, имеет 5 стадий: 1) преобразование сигнала внешнего раздражения; 2) генерация рецепторного потенциала; 3) распространение рецепторного потенциала по нейрону; 4) возникновение генераторного потенциала; 5) генерация нервного импульса.
2.2.3. Афферентные нейроны, их функции
Афферентные нейроны — нейроны, воспринимающие информацию. Как правило, афферентные нейроны имеют большую разветвленную сеть. Это характерно для всех уровней ЦНС. В зад них рогах спинного мозга афферентными являются чувствительные нейроны малых размеров с большим числом дендритных отростков, в то время как в передних рогах спинного мозга эфферентные нейроны имеют тело большого размера, более грубые, менее ветвящиеся отростки. Эти различия нарастают по мере изменения уровня ЦНС к продолговатому, среднему, промежуточному, конечному мозгу. Наибольшие различия афферентных и эфферентных нейронов отмечаются в коре большого мозга.
2.2.4. Вставочные нейроны, их роль в формировании нейронных сетей
Вставочные нейроны, или интернейроны, обрабатывают информацию, получаемую от афферентных нейронов, и передают ее на другие вставочные или на эфферентные нейроны.
Область влияния вставочных нейронов определяется их собственным строением (длина аксона, число коллатералей аксонов). Вставочные нейроны, как правило, имеют аксоны, терминали которых заканчиваются на нейронах своего же центра, обеспечивая прежде всего их интеграцию. Одни вставочные нейроны получают активацию от нейронов других центров и затем распространяют эту информацию на нейроны своего центра. Это обеспечивает усиление влияния сигнала за счет его повторения в параллельных путях и удлиняет время сохранения информации в центре. В итоге центр, куда пришел сигнал, повышает надежность воздействия на исполнительную структуру.
Другие вставочные нейроны получают активацию от коллатералей эфферентных нейронов своего же центра и затем передают эту информацию назад в свой же центр, образуя обратные связи. Так организуются реверберирующие сети, позволяющие длительно сохранять информацию в нервном центре.
Вставочные нейроны могут быть возбуждающими или тормозными.
Активация возбуждающих вставочных нейронов в новой коре облегчает передачу информации с одной группы нейронов в другую. Причем это происходит за счет «медленных» пирамидных нейронов, способных к длительной тонической активации и поэтому передающих сигналы достаточно медленно и длительно. Одновременно эти же вставочные нейроны своими коллатералями активируют и «быстрые» пирамидные нейроны, которые разряжаются физически-коротким залпом. Усиление активности «медленных» нейронов усиливает реакцию «быстрых», в то же время «быстрые» нейроны тормозят работу «медленных».
Тормозные вставочные нейроны возбуждаются прямыми сигналами, идущими в их собственный центр, или сигналами, идущими из того же центра, но по обратным связям. Прямое возбуждение тормозящих вставочных нейронов характерно для промежуточных центров афферентных спиноцеребральных путей.
Для двигательных центров коры и спинного мозга характерно возбуждение вставочных нейронов за счет обратных связей.
Эфферентные нейроны нервной системы — это нейроны, передающие информацию от нервного центра к исполнительным органам или другим центрам нервной системы. Например, эфферентные нейроны двигательной зоны коры большого мозга — пирамидные клетки, посылают импульсы к мотонейронам передних рогов спинного мозга, т. е. они являются эфферентными для этого отдела коры большого мозга. В свою очередь мотонейроны спинного мозга являются эфферентными для его передних рогов и посылают сигналы к мышцам. Основной особенностью эфферентных нейронов является наличие длинного аксона, обладающего большой скоростью проведения возбуждения.
Эфферентные нейроны разных отделов коры больших полушарий связывают между собой эти отделы по аркуатным связям. Такие связи обеспечивают внутриполушарные и межполушарные отношения, формирующие функциональное состояние мозга в динамике обучения, утомления, при распознавании образов и т. д. Все нисходящие пути спинного мозга (пирамидный, руброспинальный, ретикулоспинальный и т. д.) образованы аксонами эфферентных нейронов соответствующих отделов центральной нервной системы.
Нейроны автономной нервной системы, например ядер блуждающего нерва, боковых рогов спинного мозга, также относятся к эфферентным.
2.2.5. Нейроглия
Нейроглия, или глия, — совокупность клеточных элементов нервной ткани, образованная специализированными клетками раз личной формы. Она обнаружена Р. Вирховым и названа им нейроглией, что означает «нервный клей». Клетки нейроглии заполняют пространства между нейронами, составляя 40% от объема мозга. Глиальные клетки по размеру в 3—4 раза меньше, чем нервные; число их в ЦНС млекопитающих достигает 140 млрд. С возрастом у человека в мозге число нейронов уменьшается, а число глиальных клеток увеличивается.
Различают несколько видов нейроглии, каждая из которых образована клетками определенного типа: астроциты, олигодендроциты, микроглиоциты) (табл. 2.3).
Таблица 2.3. Количество глиальиых элементов в структурах мозга, %
|
Виды глиальных клеток |
Кора большого мозга |
Мозолистое тело |
Ствол мозга |
|
Астроциты Олигодендроциты Микроциты |
61,5 29 9,5 |
54 40 6 |
30 62 8 |
Астроциты представляют собой многоотростчатые клетки с ядрами овальной формы и небольшим количеством хроматина. Размеры астроцитов 7—25 мкм. Астроциты располагаются главным образом в сером веществе мозга. Ядра астроцитов содержат ДНК, протоплазма имеет пластинчатый комплекс, центрисому, митохондрии. Считают, что астроциты служат опорой нейронов, обеспечивают репаративные процессы нервных стволов, изолируют нервное волокно, участвуют в метаболизме нейронов. Отростки астроцитов образуют «ножки», окутывающие капилляры, практически полностью покрывая их. В итоге между нейронами и капиллярами рас полагаются только астроциты. Видимо, они обеспечивают транспорт веществ из крови в нейрон и обратно. Астроциты образуют мостики между капиллярами и эпендимой, выстилающей полости желудочков мозга. Считают, что таким образом обеспечивается обмен между кровью и цереброспинальной жидкостью желудочков мозга, т. е. астроциты выполняют транспортную функцию.
Олигодендроциты — клетки, имеющие малое количество отростков. Они меньше по размеру, чем астроциты. В коре большого мозга количество олигодендроцитов возрастает от верхних слоев к нижним. В подкорковых структурах, в стволе мозга олигодендроцитов больше, чем в коре. Олигодендроциты участвуют в миелинизации аксонов (поэтому их больше в белом веществе мозга), в метаболизме нейронов, а также трофике нейронов.
Микроглия представлена самыми мелкими многоотростчатыми клетками глии, относящимися к блуждающим клеткам. Источником микроглии служит мезодерма. Микроглиальные клетки способны к фагоцитозу.
Одной из особенностей глиальных клеток является их способность к изменению размеров. Это свойство было обнаружено в культуре ткани при помощи киносъемки. Изменение размера глиальных клеток носит ритмический характер: фаза сокращения составляет 90 с, расслабления — 240 с, т. е. это очень медленный процесс. Частота «пульсации» варьирует от 2 до 20 в час. «Пульсация» происходит в виде ритмического уменьшения объема клетки. Отростки клетки набухают, но не укорачиваются. «Пульсация» усиливается при электрической стимуляции глии; латентный период в этом случае весьма большой — около 4 мин.
Глиальная активность изменяется под влиянием различных биологически активных веществ: серотонин вызывает уменьшение «пульсации» олигодендроглиоцитов, норадреналин — усиление. Физиологическая роль «пульсации» глиальных клеток мало изучена, но считают, что она проталкивает аксоплазму нейрона и влияет на ток жидкости в межклеточном пространстве.
Нормальные физиологические процессы в нервной системе во многом зависят от степени миелинизации волокон нервных клеток. В центральной нервной системе миелинизация обеспечивается олигодендроцитами, а в периферической — леммоцитами (шванновские клетки).
Глиальные клетки не обладают импульсной активностью, подобно нервным, однако мембрана глиальных клеток имеет заряд, формирующий мембранный потенциал, который отличается большой инертностью. Изменения мембранного потенциала медленны, зависят от активности нервной системы, обусловлены не синаптическими влияниями, а изменениями химического состава межклеточной среды. Мембранный потенциал нейроглии равен 70— 90 мВ.
Глиальные клетки способны к передаче возбуждения, распространение которого от одной клетки к другой идет с декрементом. При расстоянии между раздражающим и регистрирующим электродами 50 мкм распространение возбуждения достигает точки регистрации за 30—60 мс. Распространению возбуждения между глиальными клетками способствуют специальные щелевые контакты их мембран. Эти контакты обладают пониженным сопротивлением и создают условия для электротонического распространения тока от одной глиальной клетки к другой.
Вследствие того, что нейроглия очень тесно контактирует с нейронами, процессы возбуждения нервных элементов сказываются на электрических явлениях глиальных элементов. Это влияние может быть обусловлено тем, что мембранный потенциал нейроглии зависит от концентрации ионов К+ в окружающей среде. Во время возбуждения нейрона и реполяризации его мембраны вход ионов К+ в нейрон усиливается, что значительно изменяет его концентрацию вокруг нейроглии и приводит к деполяризации ее клеточных мембран.
|
|
|
Рис. 2.17. Строение нейрона и миелинового нервного волокна. А — нейромоторная единица; 1 — узловой перехват (перехват Ранвье); 2 — синапс; Б — участок нервного волокна с узловым перехватом. Стрелками указано направление распространения возбуждения. |
2.2.6. Проведение возбуждения по нервам
Основной функцией аксонов является проведение импульсов, возникающих в нейроне. Аксоны могут быть покрыты миелиновой оболочкой (миелиновые волокна) или лишены ее (безмиелиновые волокна). Миелиновые волокна чаще встречаются в двигательных нервах, безмиелиновые преобладают в автономной (вегетативной) нервной системе.
Отдельное миелиновое нервное волокно состоит из осевого цилиндра, покрытого миелиновой оболочкой, образованной шванновскими клетками. Осевой цилиндр имеет мембрану и аксоплазму. Миелиновая оболочка является продуктом деятельности шванновской клетки и состоит на 80% из липидов, обладающих высоким омическим сопротивлением, и на 20% из белка.
Миелиновая оболочка не покрывает сплошным покровом осевой цилиндр, а прерывается, оставляя открытые участки осевого цилиндра, называемые узловыми перехватами (перехваты Ранвье). Длина участков между этими перехватами различна и зависит от толщины нервного волокна: чем оно толще, тем длиннее расстояние между перехватами (рис. 2.17).
Безмиелиновые нервные волокна покрыты только шванновской оболочкой.
Проведение возбуждения в безмиелиновых волокнах отличается от такового в миелиновых волокнах благодаря разному строению оболочек. В безмиелиновых волокнах возбуждение постепенно охватывает соседние участки мембраны осевого цилиндра и так распространяется до конца аксона. Скорость распространения возбуждения по волокну определяется его диаметром.
В нервных безмиелиновых волокнах, где процессы метаболизма не обеспечивают быструю компенсацию расхода энергии на возбуждение, распространение этого возбуждения идет с постепенным ослаблением — с декрементом. Декрементное проведение возбуждения характерно для низкоорганизованной нервной системы.
У высших животных благодаря прежде всего наличию миелиновой оболочки и совершенства метаболизма в нервном волокне возбуждение проходит, не затухая, бездекрементно. Этому способствуют наличие на всем протяжении мембраны волокна равного заряда и быстрое его восстановление после прохождения возбуждения.
В миелиновых волокнах возбуждение охватывает только участки узловых перехватов, т. е. минует зоны, покрытые миелином. Такое проведение возбуждения по волокну называется сальтаторным (скачкообразным). В узловых перехватах количество натриевых каналов достигает 12 000 на 1 мкм , что значительно больше, чем в любом другом участке волокна. В результате узловые перехваты являются наиболее возбудимыми и обеспечивают большую скорость проведения возбуждения. Время проведения возбуждения по миелиновому волокну обратно пропорционально длине между перехватами.
Проведение возбуждения по нервному волокну не нарушается в течение длительного (многочасового) времени. Это свидетельствует о малой утомляемости нервного волокна. Считают, что нервное волокно относительно неутомляемо вследствие того, что процессы ресинтеза энергии в нем идут с достаточно большой скоростью и успевают восстановить траты энергии, происходящие при прохождении возбуждения.
В момент возбуждения энергия нервного волокна тратится на работу натрий-калиевого насоса. Особенно большие траты энергии происходят в перехватах Ранвье вследствие большой плотности здесь натрий-калиевых каналов.
Дж. Эрлангер и X. Гассер (1937) впервые классифицировали нервные волокна пс скорости проведения возбуждения. Различная скорость проведения возбуждения по волокнам смешанного нерва вы является при использовании внеклеточного электрода. Потенциалы волокон, проводящих возбуждение с неодинаковой скоростью, регистрируются раздельно (рис. 2.18).
В зависимости от скорости проведения возбуждения нервные волокна делят на три типа: А, В, С. В свою очередь волокна типа А подразделяют на четыре группы: Аα, Aβ, Aγ, Aδ. Наибольшей скоростью проведения (до 120 м/с) обладают волокна группы Аα, которую составляют волокна диаметром 12—22 мкм. Другие волокна имеют меньший диаметр и соответственно проведение возбуждения по ним происходит с меньшей скоростью (табл. 2.4).
Нервный ствол образован большим числом волокон, однако возбуждение, идущее по каждому из них, не передается на соседние. Эта особенность проведения возбуждения по нерву носит название закона изолированного проведения возбуждения по отдельному нервному волокну. Возможность такого проведения имеет большое физиологическое значение, так как обеспечивает, например, изолированность сокращения каждой нейромоторной единицы.
|
|
|
Рис. 2.18. Выделение потенциалов действия разных групп волокон из общего тока действия седалищного нерва [Д. Эрлангеру. X. Гассеру]. A — расщепление суммарного потенциала возбуждения нервного ствола (цифры слева — расстояние отводящих электродов от места раздражения в мм); Б — появление дополнительного пика группы волокон низкой возбудимости в результате увеличения силы (а — слабое, б — сильное) раздражения нерва. Стрелками обозначен момент раздражения, α,β — потенциалы волокон высокой и низкой скорости проведения возбуждения. |
Способность нервного волокна к изолированному проведению возбуждения обусловлена наличием оболочек, а также тем, что сопротивление жидкости, заполняющей межволоконные пространства, значительно ниже, чем сопротивления мембраны волокна. Поэтому ток, выйдя из возбужденного волокна, шунтируется в жидкости и оказывается слабым для возбуждения соседних волокон. Необходимым условием проведения возбуждения в нерве является не просто его анатомическая непрерывность, но и физиологическая целостность. В любом металлическом проводнике электрический ток будет течь до тех пор, пока проводник сохраняет физическую непрерывность. Для нервного «проводника» этого условия недостаточно: нервное волокно должно сохранять также физиологическую целостность. Если нарушить свойства мембраны волокна (перевязка, блокада новокаином, аммиаком и др.), проведение возбуждения по волокну прекращается. Другим свойством, характерным для проведения возбуждения по нервному волокну, является способность к двустороннему проведению. Нанесение раздражения между двумя отводящими электродами на поверхности волокна вызовет электрические потенциалы под каждым из них.
Таблица 2.4. Скорость проведения возбуждения по нервным волокнам
|
Группа волокон |
Диаметр волокна, мкм |
Скорость проведения, м/с |
|
А |
||
|
Аα |
12—22 |
70—120 |
|
Аβ |
8—12 |
40—70 |
|
Аγ |
4—8 |
15—40 |
|
Аδ |
1—4 |
5—15 |
|
В |
1—3 |
3—14 |
|
С |
0,5—1,0 |
0,5—2 |
Синапсами называются контакты, которые устанавливают нейроны как самостоятельные образования. Синапс представляет собой сложную структуру и состоит из пресинаптической части (окончание аксона, передающее сигнал), синаптической щели и постсинаптической части (структура воспринимающей клетки).
Классификация синапсов. Синапсы классифицируются по местоположению, характеру действия, способу передачи сигнала.
По местоположению выделяют нервно-мышечные синапсы и нейронейрональные, последние в свою очередь делятся на аксосоматические, аксоаксональные, аксодендритические, дендросоматические.
По характеру действия на воспринимающую структуру синапсы могут быть возбуждающими и тормозящими.
По способу передачи сигнала синапсы делятся на электрические, химические, смешанные.
Характер взаимодействия нейронов. Определяется способом этого взаимодействия: дистантное, смежное, контактное.
Дистантное взаимодействие может быть обеспечено двумя нейронами, расположенными в разных структурах организма. Например, в клетках ряда структур мозга образуются нейрогормоны, нейропептиды, которые способны воздействовать гуморально на нейроны других отделов.
Смежное взаимодействие нейронов осуществляется в случае, когда мембраны нейронов разделены только межклеточным пространством. Обычно такое взаимодействие имеется там, где между мембранами нейронов нет глиальных клеток. Такая смежность характерна для аксонов обонятельного нерва, параллельных волокон мозжечка и т. д. Считают, что смежное взаимодействие обеспечивает участие соседних нейронов в выполнении единой функции. Это происходит, в частности, потому, что метаболиты, продукты активности нейрона, попадая в межклеточное пространство, влияют на соседние нейроны. Смежное взаимодействие может в ряде случаев обеспечивать передачу электрической информации от нейрона к нейрону.
Контактное взаимодействие обусловлено специфическими контактами мембран нейронов, которые образуют так называемые электрические и химические синапсы.
Электрические синапсы. Морфологически представляют собой слияние, или сближение, участков мембран. В последнем случае синаптическая щель не сплошная, а прерывается мостиками полного контакта. Эти мостики образуют повторяющуюся ячеистую структуру синапса, причем ячейки ограничены участками сближенных мембран, расстояние между которыми в синапсах млекопитающих 0,15—0,20 нм. В участках слияния мембран находятся каналы, через которые клетки могут обмениваться некоторыми продуктами. Кроме описанных ячеистых синапсов, среди электрических синапсов различают другие — в форме сплошной щели; площадь каждого из них достигает 1000 мкм, как, например, между нейронами ресничного ганглия.
Электрические синапсы обладают односторонним проведением возбуждения. Это легко доказать при регистрировании электрического потенциала на синапсе: при раздражении афферентных путей мембрана синапса деполяризуется, а при раздражении эфферентных волокон — гиперполяризуется. Оказалось, что синапсы нейронов с одинаковой функцией обладают двусторонним проведением возбуждения (например, синапсы между двумя чувствительными клетками), а синапсы между разнофункциональными нейронами (сенсорные и моторные) обладают односторонним проведением. Функции электрических синапсов заключаются прежде всего в обеспечении срочных реакций организма. Этим, видимо, объясняется расположение их у животных в структурах, обеспечивающих реакцию бегства, спасения от опасности и т. д.
Электрический синапс сравнительно мало утомляем, устойчив к изменениям внешней и внутренней среды. Видимо, эти качества наряду с быстродействием обеспечивают высокую надежность его работы.
Химические синапсы. Структурно представлены пресинаптической частью, синаптической щелью и постсинаптической частью. Пресинаптическая часть химического синапса образуется расширением аксона по его ходу или окончания (рис. 2.19). В пресинаптической части имеются агранулярные и гранулярные пузырьки. Пузырьки (кванты) содержат медиатор. В пресинаптическом расширении находятся митохондрии, обеспечивающие синтез медиатора, гранулы гликогена и др. При многократном раздражении пресинаптического окончания запасы медиатора в синаптических пузырьках истощаются. Считают, что мелкие гранулярные пузырьки содержат норадреналин, крупные — другие катехоламины. Агранулярные пузырьки содержат ацетилхолин. Медиаторами возбуждения могут быть также производные глутаминовой и аспарагиновой кислот.
Синаптические контакты могут быть между аксоном и дендритом (аксодендритические), аксоном и сомой клетки (аксосоматические), аксонами (аксоаксональные), дендритами (дендродендритические), дендритами и сомой клетки.
Действие медиатора на постсинаптическую мембрану заключается в повышении ее проницаемости для ионов Na+. Возникновение потока ионов Na+ из синаптической щели через постсинаптическую мембрану ведет к ее деполяризации и вызывает генерацию возбуждающего постсинаптического потенциала (ВПСП) (см. рис. 2.19).
Для синапсов с химическим способом передачи возбуждения характерны синоптическая задержка проведения возбуждения, длящаяся около 0,5 мс, и развитие постсинаптического потенциала (ПСП) в ответ на пресинаптический импульс. Этот потенциал при возбуждении проявляется в деполяризации постсинаптической мембраны, а при торможении — в гиперполяризации ее, в результате чего развивается тормозной постсинаптический потенциал (ТПСП). При возбуждении проводимость постсинаптической мембраны увеличивается.
ВПСП возникает в нейронах при действии в синапсах ацетил холина, норадреналина, дофамина, серотонина, глутаминовой кислоты, вещества Р.
ТПСП возникает при действии в синапсах глицина, гамма-аминомасляной кислоты. ТПСП может развиваться и под действием медиаторов, вызывающих ВПСП, но в этих случаях медиатор вызывает переход постсинаптической мембраны в состояние гиперполяризации.
Для распространения возбуждения через химический синапс важно, что нервный импульс, идущий по пресинаптической части, полностью гасится в синаптической щели. Однако нервный импульс вызывает физиологические изменения в пресинаптической части мембраны. В результате у ее поверхности скапливаются синаптические пузырьки, изливающие медиатор в синаптическую щель.
Переход медиатора в синаптическую щель осуществляется путем экзоцитоза: пузырек с медиатором соприкасается и сливается с пресинаптической мембраной, затем открывается выход в синаптическую щель и в нее попадает медиатор. В покое медиатор попадает в синаптическую щель постоянно, но в малом количестве. Под влиянием пришедшего возбуждения количество медиатора резко возрастает. Затем медиатор перемещается к постсинаптической мембране, действует на специфические для него рецепторы и образует на мембране комплекс медиатор—рецептор. Данный комплекс изменяет проницаемость мембраны для ионов К+ и Na+, в результате чего изменяется ее потенциал покоя.
В зависимости от природы медиатора потенциал покоя мембраны может снижаться (деполяризация), что характерно для возбуждения, или повышаться (гиперполяризация), что типично для торможения. Величина ВПСП зависит от количества выделившегося медиатора и может составлять 0,12—5,0 мВ. Под влиянием ВПСП деполяризуются соседние с синапсом участки мембраны, затем деполяризация достигает аксонного холмика нейрона, где возникает возбуждение, распространяющееся на аксон.
В тормозных синапсах этот процесс развивается следующим образом: аксонное окончание синапса деполяризуется, что приводит к появлению слабых электрических токов, вызывающих мобилизацию и выделение в синаптическую щель специфического тормозного медиатора. Он изменяет ионную проницаемость постсинаптической мембраны таким образом, что в ней открываются поры диаметром около 0,5 нм. Эти поры не пропускают ионы Na+ (что вызвало бы деполяризацию мембраны), но пропускают ионы К+ из клетки наружу, в результате чего происходит гиперполяризация постсинаптической мембраны.
Такое изменение потенциала мембраны вызывает развитие ТПСП. Его появление связывают с выделением в синаптическую щель специфического медиатора. В синапсах разных нервных структур роль тормозного медиатора могут выполнять различные вещества. В ганглиях моллюсков роль тормозного медиатора выполняет ацетилхолин, в ЦНС высших животных — гамма-аминомасляная кислота, глицин.
Нервно-мышечные синапсы обеспечивают проведение возбуждения с нервного волокна на мышечное благодаря медиатору ацетилхолину, который при возбуждении нервного окончания переходит в синаптическую щель и действует на концевую пластинку мышечного волокна. Следовательно, как и межнейронный синапс, нервно-мышечный синапс имеет пресинаптическую часть, принадлежащую нервному окончанию, синаптическую щель, постсинаптическую часть (концевая пластинка), принадлежащую мышечному волокну.
В пресинаптической терминали образуется и скапливается в виде пузырьков ацетилхолин. При возбуждении электрическим импульсом, идущим по аксону, пресинаптической части синапса ее мембрана становится проницаемой для ацетилхолина.
Эта проницаемость возможна благодаря тому, что в результате деполяризации пресинаптической мембраны открываются ее кальциевые каналы. Ион Са2+ входит в пресинаптическую часть синапса из синаптической щели. Ацетилхолин высвобождается и проникает в синаптическую щель. Здесь он взаимодействует со своими рецепторами постсинаптической мембраны, принадлежащей мышечному волокну. Рецепторы, возбуждаясь, открывают белковый канал, встроенный в липидный слой мембраны. Через открытый канал внутрь мышечной клетки проникают ионы Na+, что приводит к деполяризации мембраны мышечной клетки, в результате развивается так называемый потенциал концевой пластинки (ПКП). Он вызывает генерацию потенциала действия мышечного волокна.
Нервно-мышечный синапс передает возбуждение в одном направлении: от нервного окончания к постсинаптической мембране мышечного волокна, что обусловлено наличием химического звена в механизме нервно-мышечной передачи.
Скорость проведения возбуждения через синапс намного меньше, чем по нервному волокну, так как здесь тратится время на активацию пресинаптической мембраны, переход через нее кальция, выделение ацетилхолина в синаптическую щель, деполяризацию постсинаптической мембраны, развитие ПКП.
Синаптическая передача возбуждения имеет рад свойств:
1) наличие медиатора в пресинаптической части синапса;
2) относительная медиаторная специфичность синапса, т. е. каждый синапс имеет свой доминирующий медиатор;
3) переход постсинаптической мембраны под влиянием медиаторов в состояние де- или гиперполяризации;
4) возможность действия специфических блокирующих агентов на рецептирующие структуры постсинаптической мембраны;
5) увеличение длительности постсинаптического потенциала мембраны при подавлении действия ферментов, разрушающих синаптической медиатор;
6) развитие в постсинаптической мембране ПСП из миниатюрных потенциалов, обусловленных квантами медиатора;
7) зависимость длительности активной фазы действия медиатора в синапсе от свойств медиатора;
8) односторонность проведения возбуждения;
9) наличие хемочувствительных рецепторуправляемых каналов постсинаптической мембраны;
10) увеличение выделения квантов медиатора в синаптическую щель пропорционально частоте приходящих по аксону импульсов;
11) зависимость увеличения эффективности синаптической передачи от частоты использования синапса («эффект тренировки»);
12) утомляемость синапса, развивающаяся в результате длительного высокочастотного его стимулирования. В этом случае утомление может быть обусловлено истощением и несвоевременным синтезом медиатора в пресинаптической части синапса или глубокой, стойкой деполяризацией постсинаптической мембраны (пессимальное торможение).
Перечисленные свойства относятся к химическим синапсам. Электрические синапсы имеют некоторые особенности, а именно: малую задержку проведения возбуждения; возникновение деполяризации как в пре-, так и в постсинаптической частях синапса; наличие большей площади синаптической щели в электрическом синапсе, чем в химическом.
Синаптические медиаторы являются веществами, которые имеют специфические инактиваторы. Например, ацетилхолин инактивируется ацетилхолинэстеразой, норадреналин — моноаминоксидазой, катехолометилтрансферазой.
Неиспользованный медиатор и его фрагменты всасываются обратно в пресинаптическую часть синапса.
Ряд химических веществ крови и постсинаптической мембраны изменяет состояние синапса, делает его неактивным. Так, простагландины тормозят секрецию медиатора в синапсе. Другие вещества, называемые блокаторами хеморецепторных каналов, прекращают передачу в синапсах. Например, ботулинический токсин, марганец блокируют секрецию медиатора в нервно-мышечном синапсе, в тормозящих синапсах ЦНС. Тубокурарин, атропин, стрихнин, пенициллин, пикротоксин и др. блокируют рецепторы в синапсе, в результате чего медиатор, попав в синаптическую щель, не находит своего рецептора.
В то же время выделены вещества, которые блокируют системы, разрушающие медиаторы. К ним относят эзерин, фосфорорганические соединения.
В нервно-мышечном синапсе в норме ацетилхолин действует на синаптическую мембрану короткое время (1—2 мс), так как сразу же начинает разрушаться ацетилхолинэстеразой. В случаях, когда этого не происходит и ацетилхолин не разрушается на протяжении сотни миллисекунд, его действие на мембрану прекращается и мембрана не деполяризуется, а гиперполяризуется и возбуждение через этот синапс блокируется.
Блокада нервно-мышечной передачи может быть вызвана следующими способами:
1) действие местноанестезирующих веществ, которые блокируют возбуждение в пресинаптической части;
2) блокада высвобождения медиатора в пресинаптической части (например, ботулинический токсин);
3) нарушение синтеза медиатора, например при действии гемихолиния;
4) блокада рецепторов ацетилхолина, например при действии бунгаротоксина;
5) вытеснение ацетилхолина из рецепторов, например действие кураре;
6) инактивация постсинаптической мембраны сукцинилхолином, декаметонием и др.;
7) угнетение холинэстеразы, что приводит к длительному сохранению ацетилхолина и вызывает глубокую
деполяризацию и инактивацию рецепторов синапсов. Такой эффект наблюдается при действии фосфорорганических соединений.
Специально для снижения тонуса мышц, особенно при операциях, используют блокаду нервно-мышечной передачи миорелаксантами; деполяризующие мышечные релаксанты действуют на рецепторы субсинаптической мембраны (сукцинилхолин и др.), недеполяризующие мышечные релаксанты, устраняющие действие ацетилхолина на мембрану по конкуренции (препараты группы кураре).
2.4. ФИЗИОЛОГИЯ МЫШЕЧНОЙ ТКАНИ1 ( 1 Физиология сердечной мышцы будет рассмотрена в главе 7.)
Перемещение тела в пространстве, поддержание определенной позы, работа сердца и сосудов и пищеварительного тракта у человека и позвоночных животных осуществляются мышцами двух основных типов: поперечнополосатыми (скелетной, сердечной) и гладкими, которые отличаются друг от друга клеточной и тканевой организацией, иннервацией и в определенной степени механизмами функционирования. В то же время в молекулярных механизмах мышечного сокращения между этими типами мышц есть много общего.
2.4.1.1. Классификация скелетных мышечных волокон
Скелетная мускулатура человека и позвоночных животных состоит из мышечных волокон нескольких типов, отличающихся друг от друга структурно-функциональными характеристиками. В настоящее время выделяют четыре основных типа мышечных волокон.
Медленные фазические волокна окислительного типа. Волокна этого типа характеризуются большим содержанием белка миоглобина, который способен связывать О2 (близок по своим свойствам к гемоглобину). Мышцы, которые преимущественно состоят из волокон этого типа, за их темно-красный цвет называют красными. Они выполняют очень важную функцию поддержания позы человека и животных. Предельное утомление у волокон данного типа и, следовательно, мышц наступает очень медленно, что обусловлено наличием миоглобина и большого числа митохондрий. Восстановление функции после утомления происходит быстро. Нейромоторные единицы этих мышц состоят из большого числа мышечных волокон.
Быстрые фазические волокна окислительного типа. Мышцы, которые преимущественно состоят из волокон этого типа, выполняют быстрые сокращения без заметного утомления, что объясняется большим количеством митохондрий в этих волокнах и способностью образовывать АТФ путем окислительного фосфорилирования. Как правило, число волокон, входящих в состав нейромоторной единицы, в этих мышцах меньше, чем в предыдущей группе. Основное назначение мышечных волокон данного типа заключается в выполнении быстрых, энергичных движении.
Быстрые фазические волокна с гликолитическим типом окисления. Волокна данного типа характеризуются тем, что АТФ в них образуется за счет гликолиза. Волокна этой группы содержат митохондрий меньше, чем волокна предыдущей группы. Мышцы, содержащие эти волокна, развивают быстрое и сильное сокращение, но сравнительно быстро утомляются. Миоглобин в данной группе мышечных волокон отсутствует, вследствие чего мышцы, состоящие из волокон этого типа, называют белыми.
Для мышечных волокон всех перечисленных групп характерно наличие одной, в крайнем случае нескольких концевых пластинок, образованных одним двигательным аксоном.
Тонические волокна. В отличие от предыдущих мышечных волокон в тонических волокнах двигательный аксон образует множество синаптических контактов с мембраной мышечного волокна. Развитие сокращения происходит медленно, что обусловлено низкой активностью миозиновой АТФазы. Также медленно происходит и расслабление. Мышечные волокна данного типа эффективно работают в изометрическом режиме. Эти мышечные волокна не генерируют потенциал действия и не подчиняются закону «все или ничего». Одиночный пресинаптический импульс вызывает незначительное сокращение. Серия импульсов вызовет суммацию постсинаптического потенциала и плавно возрастающую деполяризацию мышечного волокна. У человека мышечные волокна этого типа входят в состав наружных мышц глаза.
Между структурой и функцией мышечных волокон существует тесная связь. Показано, что быстрые фазические волокна имеют высоко развитую саркоплазматическую сеть и обширную сеть Т-системы, в то же время медленные волокна имеют менее развитые саркоплазматическую сеть и сеть Т-системы. Кроме того, существует различие в активности кальциевых насосов саркоплазматической сети: в быстрых волокнах она значительно выше, что позволяет этим мышечным волокнам быстро расслабляться. Большинство скелетных мышц человека состоит из мышечных волокон различных типов с преобладанием одного из типов в зависимости от функций, которые выполняет та или иная мышцы.
Мышечные волокна не являются функциональной единицей скелетной мускулатуры. Эту роль выполняет нейромоторная, или двигательная, единица, которая включает мотонейрон и группу мышечных волокон, иннервируемых разветвлениями аксона этого мотонейрона, расположенного в ЦНС. Число мышечных волокон, входящих в состав двигательной единицы, различно (табл. 2.5) и зависит от функции, которую выполняет мышца в целом.
Таблица 2.5. Число мышечных волокон в двигательной единице различных мышц
|
Мышцы |
Число мышечных волокон |
|
Глаза Пальцев руки Двуглавая мышца Камбаловидная мышца |
Менее 10 10—25 Около 750 » 2000 |
В мышцах, обеспечивающих наиболее точные и быстрые движения, двигательная единица состоит из нескольких мышечных волокон, в то время как в мышцах, участвующих в поддержании позы, двигательные единицы включают несколько сотен и даже тысяч мышечных волокон.
Величина потенциала покоя мышечных волокон составляет примерно — 90 мВ, потенциала действия — 120—130 мВ. Длительность потенциала действия 1—3 мс, величина критического потенциала — 50 мВ.
2.4.1.2. Функции и свойства скелетных мышц
Скелетная мускулатура является составной частью опорно-двигательного аппарата человека. При этом мышцы выполняют следующие функции:
1) обеспечивают определенную позу тела человека;
2) перемещают тело в пространстве;
3) перемещают отдельные части тела относительно друг друга;
4) являются источником тепла, выполняя терморегуляционную функцию.
В настоящей главе мы рассмотрим функциональные свойства мышц, связанные с участием в работе опорно-двигательного аппарата. Скелетная мышца обладает следующими важнейшими свойствами:
1) возбудимостью — способностью отвечать на действие раздражителя
изменением ионной проводимости и мембранного потенциала. В естественных условиях
этим раздражителем является медиатор ацетилхолин, который выделяется в
пресинаптических окончаниях аксонов мотонейронов. В лабораторных условиях
часто
используют электрическую стимуляцию мышцы. При электрической стимуляции
мышцы первоначально возбуждаются нервные волокна, которые выделяют ацетилхолин,
т. е. в данном случае наблюдается непрямое раздражение мышцы. Это обусловлено
тем, что возбудимость нервных волокон выше мышечных. Для прямого
раздражения мышцы необходимо применять миорелаксанты — вещества,
блокирующие передачу нервного импульса через нервно-мышечный
синапс;
2) проводимостью — способностью проводить потенциал действия вдоль и в глубь мышечного волокна по Т-системе;
3) сократимостью — способностью укорачиваться или развивать напряжение при возбуждении;
4) эластичностью — способностью развивать напряжение при растягивании.
2.4.1.3. Механизм мышечного сокращения
Скелетная мышца представляет собой сложную систему, преобразующую химическую энергию в механическую работу и тепло. В настоящее время хорошо исследованы молекулярные механизмы этого преобразования.
Структурная организация мышечного волокна. Мышечное волокно является многоядерной структурой, окруженной мембраной и содержащей специализированный сократительный аппарат — миофибриллы. Кроме этого, важнейшими компонентами мышечного волокна являются митохондрии, системы продольных трубочек — саркоплазматическая сеть (ретикулум) и система поперечных трубочек — Т-система. Функциональной единицей сократительного аппарата мышечной клетки является саркомер (рис. 2.20,А); из саркомеров состоит миофибрилла. Саркомеры отделяются друг от друга Z-пластинками. Саркомеры в миофибрилле расположены последовательно, поэтому сокращение саркомеров вызывает сокращение миофибриллы и общее укорочение мышечного волокна.
Изучение структуры мышечных волокон в световом микроскопе позволило выявить их поперечную исчерченность. Электронно-микроскопические исследования показали, что поперечная исчерченность обусловлена особой организацией сократительных белков миофибрилл — актина (молекулярная масса 42 000) и миозина (молекулярная масса около 500 000). Актиновые филаменты представлены двойной нитью, закрученной в двойную спираль с шагом около 36,5 нм. Эти филаменты длиной 1 мкм и диаметром 6—8 нм, количество которых достигает около 2000, одним концом прикреплены к Z-пластинке. В продольных бороздках актиновой спирали располагаются нитевидные молекулы белка тропомиозина. С шагом, равным 40 нм, к молекуле тропомиозина прикреплена молекула другого белка — тропонина. Тропонин и тропомиозин играют важную роль в механизмах взаимодействия актина и миозина. В середине саркомера между нитями актина располагаются толстые нити миозина длиной около 1,6 мкм. В поляризационном микроскопе эта область видна в виде полоски темного цвета (вследствие двойного лучепреломления) — анизотропный А-диск. В центре его видна более светлая полоска Н. В ней в состоянии покоя нет актиновых нитей. По обе стороны А-диска видны светлые изотропные полоски — I-диски, образованные нитями актина. В состоянии покоя нити актина и миозина незначительно перекрывают друг друга таким образом, что общая длина саркомера составляет около 2,5 мкм. При электронной микроскопии в центре Н-полоски обнаружена М-ли-ния — структура, которая удерживает нити миозина. На поперечном срезе мышечного волокна можно увидеть гексагональную организацию миофиламента: каждая нить миозина окружена шестью нитями актина (рис. 2.20, Б).
При электронной микроскопии видно, что на боковых сторонах миозиновой нити обнаруживаются выступы, получившие название поперечных мостиков. Они ориентированы по отношению к оси миозиновой нити под углом 120°. Согласно современным представлениям, поперечный мостик состоит из головки и шейки. Головка приобретает выраженную АТФазную активность при связывании с актином. Шейка обладает эластическими свойствами и представляет собой шарнирное соединение, поэтому головка поперечного мостика может поворачиваться вокруг своей оси.
Использование микроэлектродной техники в сочетании с интерференционной микроскопией позволило установить, что нанесение электрического раздражения на область Z-пластинки приводит к сокращению саркомера, при этом размер зоны диска А не изменяется, а величина полосок Н и I уменьшается. Эти наблюдения свидетельствовали о том, что длина миозиновых нитей не изменяется. Аналогичные результаты были получены при растяжении мышцы — собственная длина актиновых и миозиновых нитей не изменялась. В результате этих экспериментов выяснилось, что изменялась область взаимного перекрытия актиновых и миозиновых нитей. Эти факты позволили Н. Huxley и A. Huxley предложить независимо друг от друга теорию скольжения нитей для объяснения механизма мышечного сокращения. Согласно этой теории, при сокращении происходит уменьшение размера саркомера вследствие активного перемещения тонких актиновых нитей относительно толстых миозиновых. В настоящее время выяснены многие детали этого механизма и теория получила экспериментальное подтверждение.
Механизм мышечного сокращения. В процессе сокращения мышечного волокна в нем происходят следующие преобразования:
А. Электрохимическое преобразование:
1. Генерация ПД.
2. Распространение ПД по Т-системе.
3. Электрическая стимуляция зоны контакта Т-системы и саркоплазматического ретикулума, активация ферментов, образование инозитолтрифосфата, повышение внутриклеточной концентрации ионов Са2+.
Б. Хемомеханическое преобразование:
4. Взаимодействие ионов Са2+ с тропонином, освобождение активных центров на актиновых филаментах.
5. Взаимодействие миозиновой головки с актином, вращение головки и развитие эластической тяги.
6. Скольжение нитей актина и миозина относительно друг друга, уменьшение размера саркомера, развитие напряжения или укорочение мышечного волокна.
Передача возбуждения с двигательного мотонейрона на мышечное волокно происходит с помощью медиатора ацетилхолина (АХ). Взаимодействие АХ с холинорецептором концевой пластинки приводит к активации АХ-чувствительных каналов и появлению потенциала концевой пластинки, который может достигать 60 мВ. При этом область концевой пластинки становится источником раздражающего тока для мембраны мышечного волокна и на участках клеточной мембраны, прилегающих к концевой пластинке, возникает ПД, который распространяется в обе стороны со скоростью примерно 3—5 м/с при температуре 36 oС. Таким образом, генерация ПД является первым этапом мышечного сокращения.
Вторым этапом является распространение ПД внутрь мышечного волокна по поперечной системе трубочек, которая служит связующим звеном между поверхностной мембраной и сократительным аппаратом мышечного волокна. Т-система тесно контактирует с терминальными цистернами саркоплазматической сети двух соседних саркомеров. Электрическая стимуляция места контакта приводит к активации ферментов, расположенных в месте контакта и образованию инозитолтрифосфата. Инозитолтрифосфат активирует кальциевые каналы мембран терминальных цистерн, что приводит к выходу ионов Са2+ из цистерн и повышению внутриклеточной концентрации Са2+ с 107до 105 M. Совокупность процессов, приводящих к повышению внутриклеточной концентрации Са2+ составляет сущность третьего этапа мышечного сокращения. Таким образом, на первых этапах происходит преобразование электрического сигнала ПД в химический — повышение внутриклеточной концентрации Са2+, т. е. электрохимическое преобразование.
При повышении внутриклеточной концентрации ионов Са2+ тропомиозин смещается в желобок между нитями актина, при этом на актиновых нитях открываются участки, с которыми могут взаимодействовать поперечные мостики миозина. Это смещение тропомиозина обусловлено изменением конформации молекулы белка тропонина при связывании Са2+ . Следовательно, участие ионов Са2+ в механизме взаимодействия актина и миозина опосредовано через тропонин и тропомиозин.
|
|
|
Рис. 2.21 Процесс высвобождения кальция (изучение с помощью экворина). 1 – импульс тока; 2 – мембранный потенциал; 3 – интенсивность свечения экворина при реакции в внутриклеточным кальцием; 4 – мышечное напряжение. |
Существенная роль кальция в механизме мышечного сокращения была доказана в опытах с применением белка экворина, который при взаимодействии с кальцием излучает свет. После инъекции экворина мышечное волокно подвергали электрической стимуляции и одновременно измеряли мышечное напряжение в изометрическом режиме и люминесценцию экворина. Обе кривые полностью коррелировали друг с другом (рис. 2.21). Таким образом, четвертым этапом электромеханического сопряжения является взаимодействие кальция с тропонином.
Следующим, пятым, этапом электромеханического сопряжения является присоединение головки поперечного мостика к актиновому филаменту к первому из нескольких последовательно расположенных стабильных центров. При этом миозиновая головка поворачивается вокруг своей оси, поскольку имеет несколько активных центров, которые последовательно взаимодействуют с соответствующими центрами на актиновом филаменте. Вращение головки приводит к увеличению упругой эластической тяги шейки поперечного мостика и увеличению напряжения. В каждый конкретный момент в процессе развития сокращения одна часть головок поперечных мостиков находится в соединении с актиновым филаментом, другая свободна, т. е. существует последовательность их взаимодействия с актиновым филаментом. Это обеспечивает плавность процесса сокращения. На четвертом и пятом этапах происходит хемомеханическое преобразование.
Последовательная реакция соединения и разъединения головок поперечных мостиков с актиновым филаментом приводит к скольжению тонких и толстых нитей относительно друг друга и уменьшению размеров саркомера и общей длины мышцы, что является шестым этапом. Совокупность описанных процессов составляет сущность теории скольжения нитей (рис. 2.22).
|
|
|
Рис. 2.22. Иллюстрация теории скользящих нитей. А, а — мышца в покое; А, б — мышца при сокращении; Б, а, б — последовательное взаимодействие активных центров миоэиновой головки с центрами на актиновой нити. |
Первоначально полагали, что ионы Са2+ служат кофактором АТФазной активности миозина. Дальнейшие исследования опровергли это предположение. У покоящейся мышцы актин и миозин практически не обладают АТФазной активностью. Присоединение головки миозина к актину приводит к тому, что головка приобретает АТФазную активность.
Гидролиз АТФ в АТФазном центре головки миозина сопровождается изменением конформации последней и переводом ее в новое, высокоэнергетическое состояние. Повторное присоединение миозиновой головки к новому центру на актиновом филаменте вновь приводит к вращению головки, которое обеспечивается запасенной в ней энергией. В каждом цикле соединения и разъединения головки миозина с актином расщепляется одна молекула АТФ на каждый мостик. Быстрота вращения определяется скоростью расщепления АТФ. Очевидно, что быстрые фазические волокна потребляют значительно больше АТФ в единицу времени и сохраняют меньше химической энергии во время тонической нагрузки, чем медленные волокна. Таким образом, в процессе хемомеханического преобразования АТФ обеспечивает разъединение головки миозина и актинового филамента и энергетику для дальнейшего взаимодействия головки миозина с другим участком актинового филамента. Эти реакции возможны при концентрации кальция выше 106М.
Описанные механизмы укорочения мышечного волокна позволяют предположить, что для расслабления в первую очередь необходимо понижение концентрации ионов Са2+. Экспериментально было доказано, что саркоплазматическая сеть имеет специальный механизм — кальциевый насос, который активно возвращает кальций в цистерны. Активация кальциевого насоса осуществляется неорганическим фосфатом, который образуется при гидролизе АТФ, а энергообеспечение работы кальциевого насоса также за счет энергии, образующейся при гидролизе АТФ. Таким образом, АТФ является вторым важнейшим фактором, абсолютно необходимым для процесса расслабления. Некоторое время после смерти мышцы остаются мягкими вследствие прекращения тонического влияния мотонейронов (см. главу 4). Затем концентрация АТФ снижается ниже критического уровня и возможность разъединения головки миозина с актиновым филаментом исчезает. Возникает явление трупного окоченения с выраженной ригидностью скелетных мышц.
2.4.1.4. Режимы мышечного сокращения
Сократительная способность скелетной мышцы характеризуется силой сокращения, которую развивает мышца (обычно оценивают общую силу, которую может развивать мышца, и абсолютную, т. е. силу, приходящуюся на 1 см2 поперечного сечения).длиной укорочения, степенью напряжения мышечного волокна, скоростью укорочения и развития напряжения, скоростью расслабления. Поскольку эти параметры в большой степени определяются исходной длиной мышечных волокон и нагрузкой на мышцу, исследования сократительной способности мышцы производят в различных режимах.
Раздражение мышечного волокна одиночным пороговым или сверхпороговым стимулом приводит к возникновению одиночного сокращения, которое состоит из нескольких периодов (рис. 2.23). Первый — латентный период представляет собой сумму временных задержек, обусловленных возбуждением мембраны мышечного волокна, распространением ПД по Т-системе внутрь волокна, образованием инозитолтрифосфата, повышением концентрации внутриклеточного кальция и активации поперечных мостиков. Для портняжной мышцы лягушки латентный период составляет около 2 мс.
|
|
|
Рис. 2.23. Фазы одиночного мышечного сокращения А — потенциал действия; Б — мышечное сокращение; 1 — латентный период; 2 — период развития напряженна, или укорочения; 3 — период расслабления. |
Второй — период укорочения, или развития напряжения. В случае свободного укорочения мышечного волокна говорят об изотоническом режиме сокращения, при котором напряжение практически не изменяется, а меняется только длина мышечного волокна. Если мышечное волокно закреплено с двух сторон и не может свободно укорачиваться, то говорят об изометрическом режиме сокращение Строго говоря, при данном режиме сокращения длина мышечного волокна не изменяется, в то время как размеры саркомеров меняются за счет скольжения нитей актина и миозина относительно друг друга. В этом случае возникающее напряжение передается на эластические элементы, расположенные внутри волокна. Эластическими свойствами обладают поперечные мостики миозиновых нитей, актиновые нити, Z-пластинки, продольно расположенная саркоплазматическая сеть и сарколемма мышечного волокна.
В опытах на изолированной мышце выявляется растяжение соединительнотканных элементов мышцы и сухожилий, которым передается напряжение, развиваемое поперечными мостиками.
В организме человека в изолированном виде изотонического или изометрического сокращения не происходит. Как правило, развитие напряжения сопровождается укорочением длины мышцы — ауксотонический режим сокращение
Третий — период расслабления, когда уменьшается концентрация ионов Са2+ и отсоединяются головки миозина от актиновых филаментов.
Полагают, что для одиночного мышечного волокна напряжение, развиваемое любым саркомером, равно напряжению в любом другом саркомере. Поскольку саркомеры соединены последовательно, скорость, с которой происходит сокращение мышечного волокна, пропорциональна числу его саркомеров. Таким образом при одиночном сокращении скорость укорочения длинного мышечного волокна выше, чем у более короткого. Величина усилия, развиваемого мышечным волокном, пропорциональна числу миофибрилл в волокне. При мышечной тренировке число миофибрилл увеличивается, что является морфологическим субстратом увеличения силы сокращения мышц. Одновременно увеличивается и число митохондрии, повышающих выносливость мышечного волокна при физической нагрузке.
|
|
|
Рис. 2.24 Зависимость силы от скорости сокращения мышц. OKVS – площадь, соответствующая оптимальной мощности сокращения мышц. |
В изолированной мышце величина и скорость одиночного сокращения определяются рядом дополнительных факторов. Величина одиночного сокращения в первую очередь будет определяться числом двигательных единиц, участвующих в сокращении. Поскольку мышцы состоят из мышечных волокон с различным уровнем возбудимости, имеется определенная зависимость между величиной стимула и ответной реакцией. Увеличение силы сокращения возможно до определенного предела, после которого амплитуда сокращения остается неизменной при увеличении амплитуды стимула. При этом все мышечные волокна, входящие в состав мышцы, принимают участие в сокращении.
Важность участия всех мышечных волокон в сокращении показана при изучении зависимости скорости укорочения от величины нагрузки. График зависимости скорости сокращения от величины нагрузки приближается к гиперболе (рис. 2.24). Поскольку сила сокращения эквивалентна нагрузке, становится понятным, что максимальная сила, которая может быть развита мышцей, приходится на очень малые скорости. Штангист может «взять рекордный вес» только при медленных движениях. Напротив, быстрые движения возможны при слабонагруженных мышцах.
|
|
|
Рис. 2.25. Механизм суммации мышечных сокращений. Стрелками показаны моменты стимуляции. Объяснение в тексте. |
Изменение силы сокращения наблюдают при ритмической стимуляции скелетных мышц.
На рис. 2.25 показаны варианты стимуляции мышцы двумя стимулами. Если второй стимул действует в период рефрактерности мышечного волокна, то он не вызовет повторного мышечного сокращения (рис. 2.25, А). Если же второй стимул действует на мышцу после окончания периода расслабления, то вновь возникает одиночное мышечное сокращение (рис. 2.25, Б).
При нанесении второго стимула в период укорочения или развития мышечного напряжения происходит суммация двух следующих друг за другом сокращений и результирующий ответ по амплитуде становится значительно выше, чем при одиночном стимуле; если мышечное волокно или мышцу стимулировать с такой частотой, что повторные стимулы будут приходиться на период укорочения, или развития напряжения, то происходит полная суммация единичных сокращений и развивается гладкий тетанус (рис. 2.25, В). Тетанус — сильное и длительное сокращение мышцы. Полагают, что в основе этого явления лежит повышение концентрации кальция внутри клетки, что позволяет осуществляться реакции взаимодействия актина и миозина и генерации мышечной силы поперечными мостиками достаточно длительное время. При уменьшении частоты стимуляции возможен вариант, когда повторный стимул наносят в период расслабления. В этом случае также возникнет суммация мышечных сокращений, однако будет наблюдаться характерное западение на кривой мышечного сокращения (рис. 2.25, Г) — неполная суммация, или зубчатый тетанус.
При тетанусе происходит суммация мышечных сокращений, в то время как ПД мышечных волокон не суммируются.
В естественных условиях одиночные сокращения скелетных мышц не встречаются. Происходит сложение, или суперпозиция, сокращений отдельных нейромоторных единиц. При этом сила сокращения может увеличиваться как за счет изменения числа двигательных единиц, участвующих в сокращении, так и за счет изменения частоты импульсации мотонейронов. В случае увеличения частоты импульсации будет наблюдаться суммация сокращений отдельных двигательных единиц.
Одной из причин увеличения силы сокращения в естественных условиях является частота импульсов, генерируемых мотонейронами. Второй причиной этого служат увеличение числа возбуждающихся мотонейронов и синхронизация частоты их возбуждения. Рост числа мотонейронов соответствует увеличению количества двигательных единиц, участвующих в сокращении, а возрастание степени синхронизации их возбуждения способствует увеличению амплитуды при суперпозиции максимального сокращения, развиваемого каждой двигательной единицей в отдельности.
|
|
|
Рис. 2.26. Зависимость силы мышечного сокращения F от длины саркомера (I). |
Сила сокращения изолированной скелетной мышцы при прочих равных условиях зависит от исходной длины мышцы. Умеренное растяжение мышцы приводит к тому, что развиваемая ею сила возрастает по сравнению с силой, развиваемой нерастянутой мышцей. Происходит суммирование пассивного напряжения, обусловленного наличием эластических компонентов мышцы, и активного сокращения. Максимальная сила сокращения достигается при размере саркомера 2—2,2 мкм (рис. 2.26). Увеличение длины саркомера приводит к уменьшению силы сокращения, поскольку уменьшается область взаимного перекрытия актиновых и миозиновых нитей. При длине саркомера 2,9 мкм мышца может развивать силу, равную только 50% от максимально возможной.
В естественных условиях сила сокращения скелетных мышц при их растяжении, например при массаже, увеличивается вследствие работы гамма-эфферентов.
2.4.1.5. Работа и мощность мышцы
Поскольку основной задачей скелетной мускулатуры является совершение мышечной работы, в экспериментальной и клинической физиологии оценивают величину работы, которую совершает мышца, и мощность, развиваемую ею при работе.
Согласно законам физики, работа есть энергия, затрачиваемая на перемещение тела с определенной силой на определенное расстояние: А = FS. Если сокращение мышцы совершается без нагрузки (в изотоническом режиме), то механическая работа равна нулю. Если при максимальной нагрузке не происходит укорочения мышцы (изометрический режим), то работа также равна нулю. В этом случае химическая энергия полностью переходит в тепловую.
Согласно закону средних нагрузок, мышца может совершать максимальную работу при нагрузках средней величины.
При сокращении скелетной мускулатуры в естественных условиях преимущественно в режиме изометрического сокращения, например при фиксированной позе, говорят о статической работе, при совершении движений — о динамической.
Сила сокращения и работа, совершаемая мышцей в единицу времени (мощность), не остаются постоянными при статической и динамической работе. В результате продолжительной деятельности работоспособность скелетной мускулатуры понижается. Это явление называется утомлением. При этом снижается сила сокращений, увеличиваются латентный период сокращения и период расслабления.
Статический режим работы более утомителен, чем динамический. Утомление изолированной скелетной мышцы обусловлено прежде всего тем, что в процессе совершения работы в мышечных волокнах накапливаются продукты процессов окисления — молочная и пировиноградная кислоты, которые снижают возможность генерирования ПД. Кроме того, нарушаются процессы ресинтеза АТФ и креатинфосфата, необходимых для энергообеспечения мышечного сокращения. В естественных условиях мышечное утомление при статической работе в основном определяется неадекватным регионарным кровотоком. Если сила сокращения в изометрическом режиме составляет более 15% от максимально возможной, то возникает кислородное «голодание» и мышечное утомление прогрессивно нарастает.
В реальных условиях необходимо учитывать состояние ЦНС — снижение силы
сокращений сопровождается уменьшением частоты импульсации нейронов,
обусловленное как их прямым угнетением, так и механизмами центрального
торможения. Еще в
Работоспособность скелетной мускулатуры и скорость развития утомления зависят от уровня умственной деятельности: высокий уровень умственного напряжения уменьшает мышечную выносливость.
2.4.1.6. Энергетика мышечного сокращения
В динамическом режиме работоспособность мышцы определяется скоростью расщепления и ресинтеза АТФ. При этом скорость расщепления АТФ может увеличиваться в 100 раз и более. Ресинтез АТФ может обеспечиваться за счет окислительного расщепления глюкозы. Действительно, при умеренных нагрузках ресинтез АТФ обеспечивается повышенным потреблением мышцами глюкозы и кислорода. Это сопровождается увеличением кровотока через мышцы примерно в 20 раз, увеличением минутного объема сердца и дыхания в 2—3 раза. У тренированных лиц (например, спортсмена) большую роль в обеспечении повышенной потребности организма в энергии играет повышение активности митохондриальных ферментов.
При максимальной физической нагрузке происходит дополнительное расщепление глюкозы путем анаэробного гликолиза. Во время этих процессов ресинтез АТФ осуществляется в несколько раз быстрее и механическая работа, производимая мышцами также больше, чем при аэробном окислении. Предельное время для такого рода работы составляет около 30 с, после чего возникает накопление молочной кислоты, т. е. метаболический ацидоз, и развивается утомление.
Анаэробный гликолиз имеет место и в начале длительной физической работы, пока не увеличится скорость окислительного фосфорилирования таким образом, чтобы ресинтез АТФ вновь сравнялся с его распадом. После метаболической перестройки спортсмен обретает как бы второе дыхание. Подробные схемы метаболических процессов приведены в руководствах по биохимии.
2.4.1.7. Теплообразование при мышечном сокращении
Согласно первому закону термодинамики, общая энергия системы и ее окружения должна оставаться постоянной.
Скелетная мышца превращает химическую энергию в механическую работу с выделением тепла. А. Хиллом было установлено, что все теплообразование можно разделить на несколько компонентов:
1. Теплота активации — быстрое выделение тепла на ранних этапах мышечного сокращения, когда отсутствуют видимые признаки укорочения или развития напряжения. Теплообразование на этой стадии обусловлено выходом ионов Са2+ из триад и соединением их с тропонином.
2. Теплота укорочения — выделение тепла при совершении работы, если речь идет не об изометрическом режиме. При этом, чем больше совершается механической работы, тем больше выделяется тепла.
3. Теплота расслабления — выделение тепла упругими элементами мышцы при расслаблении. При этом выделение тепла не связано непосредственно с процессами метаболизма.
Как отмечалось ранее, нагрузка определяет скорость укорочения. Оказалось, что при большой скорости укорочения количество выделяющегося тепла мало, а при малой скорости велико, так как количество выделяющегося тепла пропорционально нагрузке (закон Хилла для изотонического режима сокращения).
2.4.1.8. Скелетно-мышечное взаимодействие
При совершении работы развиваемое мышцей усилие передается на внешний объект с помощью сухожилий, прикрепленных к костям скелета. В любом случае нагрузка преодолевается за счет вращения одной части скелета относительно другой вокруг оси вращения.
Передача мышечного сокращения на кости скелета происходит при участии сухожилий, которые обладают высокой эластичностью и растяжимостью. В случае сокращения мышцы происходит растяжение сухожилий и кинетическая энергия, развиваемая мышцей, переходит в потенциальную энергию растянутого сухожилия. Эта энергия используется при таких формах движения как ходьба, бег, т. е. когда происходит отрыв пятки от поверхности земли.
Скорость и сила, с которой одна часть тела перемещается относительно другой, зависят от длины рычага, т. е. взаимного расположения точек прикрепления мышц и оси вращения, а также от длины, силы мышцы и величины нагрузки. В зависимости от функции, которую выполняет конкретная мышца, возможно превалирование скоростных или силовых качеств. Как уже указывалось в разделе 2.4.1.4, чем длиннее мышца, тем выше скорость ее укорочения. При этом большую роль играет параллельное расположение мышечных волокон относительно друг друга. В этом случае физиологическое поперечное сечение соответствует геометрическому (рис. 2.27, А). Примером такой мышцы может служить портняжная мышца. Напротив, силовые характеристики выше у мышц с так называемым перистым расположением мышечных волокон. При таком расположении мышечных волокон физиологическое поперечное сечение больше геометрического поперечного сечения (рис. 2.27, Б). Примером такой мышцы у человека может служить икроножная мышца.
У мышц веретенообразной формы, например у двуглавой мышцы плеча, геометрическое сечение совпадает с физиологическим только в средней части, в других областях физиологическое сечение больше геометрического, поэтому мышцы этого типа по своим характеристикам занимают промежуточное место (рис. 2.27, В).
|
|
|
Рис. 2.27. Строение различных типов мышц и их физиологическое сечение.А — портняжная мышца; Б — икроножная мышца; В — двуглавая мышца плеча |
При определении абсолютной силы различных мышц максимальное усилие, которое развивает мышца, делят на физиологическое поперечное сечение. Абсолютная сила икроножной мышцы человека составляет 5,9 кг/см , двуглавой мышцы плеча — 11,4 кг/см2 .
2.4.1.9. Оценка функционального состояния мышечной системы у человека
При оценке функционального состояния мышечной системы у человека используют различные методы.
Эргометрические методы. Эти методы используют для определения физической работоспособности. Человек совершает работу в определенных условиях и одновременно регистрируются величины выполняемой работы и различные физиологические параметры: частота дыхания, пульс, артериальное давление, объем циркулирующей крови, величина регионарного кровотока, потребляемого О2, выдыхаемого СО2 и т.д. С помощью специальных устройств — велоэргометров или тредбанов (бегущая дорожка) — создается возможность дозировать нагрузку на организм человека.
Электромиографические методы. Эти методы исследования скелетной мускулатуры человека нашли широкое применение в физиологической и клинической практике. В зависимости от задач исследования проводят регистрацию и анализ суммарной электромиограммы (ЭМГ) или потенциалов отдельных мышечных волокон. При регистрации суммарной ЭМГ чаще используют накожные электроды, при регистрации потенциалов отдельных мышечных волокон — многоканальные игольчатые электроды.
Преимуществом суммарной электромиографии произвольного усилия является неинвазивность исследования и, как правило, отсутствие электростимуляции мышц и нервов. На рис. 2.28 приведена ЭМГ мышцы в покое и при произвольном усилии. Количественный анализ ЭМГ заключается в определении частот волн ЭМГ, проведении спектрального анализа, оценки средней, амплитуды волн ЭМГ. Одним из распространенных методов анализа ЭМГ является ее интегрирование, поскольку известно, что величина интегрированной ЭМГ пропорциональна величине развиваемого мышечного усилия.
|
|
|
Рис. 2.28. Электромиограмма при физической нагрузке. 1 — отметка времени; 2 — электромиограмма; 3 — механограмма сокращения мышц. |
Используя игольчатые электроды, можно регистрировать как суммарную ЭМГ, так и электрическую активность отдельных мышечных волокон. Регистрируемая при этом электрическая активность в большей степени определяется расстоянием между отводящим электродом и мышечным волокном. Разработаны критерии оценки параметров отдельных потенциалов здорового и больного человека. На рис. 2.29 приведена запись потенциала двигательной единицы человека.
|
|
|
Рис. 2.29. Потенциал двигательной единицы (ПДЕ) (по Б. М. Гехту). А — принцип измерения параметров ПДЕ (амплитуда, длительность); 1—3 — фазы потенциала; Б — ПДЕ мышцы здорового человека; В — полифазный ПДЕ мышцы больного человека. |
Гладкие мышцы находятся в стенке внутренних органов, кровеносных и лимфатических сосудов, в коже н морфологически отличаются от скелетной и сердечной мышц отсутствием видимой поперечной исчерченности.
2.4.2.1. Классификация гладких мышц
Гладкие мышцы подразделяются на висцеральные (унитарные) и мультиунитарные (рис. 2.30). Висцеральные гладкие мышцы находятся во всех внутренних органах, протоках пищеварительных желез, кровеносных и лимфатических сосудах, коже. К мулыпиунитарным относятся ресничная мышца и мышца радужки глаза. Деление гладких мышц на висцеральные и мультиунитарные основано на различной плотности их двигательной иннервации. В висцеральных гладких мышцах двигательные нервные окончания имеются на небольшом количестве гладких мышечных клеток. Несмотря на это, возбуждение с нервных окончаний передается на все гладкие мышечные клетки пучка благодаря плотным контактам между соседними миоцитами — нексусам. Нексусы позволяют потенциалам действия и медленным волнам деполяризации распространяться с одной мышечной клетки на другую, поэтому висцеральные гладкие мышцы сокращаются одномоментно с приходом нервного импульса.
|
|
|
Рис. 2.30. Строение мультиунитарной (А) и висцеральной (Б) гладкой мышцы. 1 — вегетативное нервное волокно; 2 — гладкая мышечная клетка; 3 — варикозные расширения нервных волокон (варикозы); 4 — плотные контакты мембраны соседних гладких мышечных клеток (нексусы). |
2.4.2.2. Строение гладких мышц
Гладкие мышцы состоят из клеток веретенообразной формы, средняя длина которых 100 мкм, а диаметр 3 мкм. Клетки располагаются в составе мышечных пучков и тесно прилегают друг к другу. Мембраны прилежащих клеток образуют нексусы, которые обеспечивают электрическую связь между клетками и служат для передачи возбуждения с клетки на клетку. Гладкие мышечные клетки содержат миофиламенты актина и миозина, которые располагаются здесь менее упорядоченно, чем в волокнах скелетной мышцы. Саркоплазматическая сеть в гладкой мышце менее развита, чем в скелетной.
2.4.2.3. Иннервация гладких мышц
Висцеральная гладкая мышца имеет двойную иннервацию — симпатическую и парасимпатическую, функция которой заключается в изменении деятельности гладкой мышцы. Раздражение одного из вегетативных нервов обычно увеличивает активность гладкой мышцы, стимуляция другого — уменьшает. В некоторых органах, например кишечнике, стимуляция адренергических нервов уменьшает, а холинергических — увеличивает мышечную активность; в других, например, сосудах, норадреналин усиливает, а АХ снижает мышечный тонус. Строение нервных окончаний в гладкой мышце отличается от строения нервно-мышечного синапса скелетной мышцы. В гладкой мышце нет концевых пластинок и отдельных нервных окончаний. По всей длине разветвлений адренергических и холинергических нейронов имеются утолщения, называемые варикозами. Они содержат гранулы с медиатором, который выделяется из каждой варикозы нервных волокон. Таким образом, по ходу следования нервного волокна могут возбуждаться или тормозиться многие гладкие мышечные клетки. Клетки, лишенные непосредственных контактов с варикозами, активируются потенциалами действия, распространяющимися через нексусы на соседние клетки. Скорость проведения возбуждения в гладкой мышце невелика и составляет несколько сантиметров в секунду.
Нервно-мышечная передача. Возбуждающее влияние адренергических или холинергических нервов электрически проявляется в виде отдельных волн деполяризации. При повторной стимуляции эти потенциалы суммируются и по достижении пороговой величины возникает ПД.
Тормозящее влияние адренергических или холинергических нервов проявляется в виде отдельных волн гиперполяризации, называемых тормозными постсинаптическими потенциалами (ТПСП). При ритмической стимуляции ТПСП суммируются. Возбуждающие и тормозные постсинаптические потенциалы наблюдаются не только в мышечных клетках, контактирующих с варикозами, но и на некотором расстоянии от них. Это объясняется тем, что постсинаптические потенциалы передаются от клетки к клетке через нексусы или посредством диффузии медиатора из мест его выделения.
2.4.2.4. Функции и свойства гладких мышц
Электрическая активность. Висцеральные гладкие мышцы характеризуются нестабильным мембранным потенциалом. Колебания мембранного потенциала независимо от нервных влияний вызывают нерегулярные сокращения, которые поддерживают мышцу в состоянии постоянного частичного сокращения — тонуса. Тонус гладких мышц отчетливо выражен в сфинктерах полых органов: желчном, мочевом пузырях, в месте перехода желудка в двенадцатиперстную кишку и тонкой кишки в толстую, а также в гладких мышцах мелких артерий и артериол. Мембранный потенциал гладкомышечных клеток не является отражением истинной величины потенциала покоя. При уменьшении мембранного потенциала мышца сокращается, при увеличении — расслабляется. В периоды состояния относительного покоя величина мембранного потенциала в среднем равна — 50 мВ. В клетках висцеральных гладких мышц наблюдаются медленные волнообразные флюктуации мембранного потенциала величиной в несколько милливольт, а также ПД. Величина ПД может варьировать в широких пределах. В гладких мышцах продолжительность ПД 50—250 мс; встречаются ПД различной формы. В некоторых гладких мышцах, например мочеточника, желудка, лимфатических сосудов, ПД имеют продолжительное плато во время реполяризации, напоминающее плато потенциала в клетках миокарда. Платообразные ПД обеспечивают поступление в цитоплазму миоцитов значительного количества внеклеточного кальция, участвующего в последующем в активации сократительных белков гладкомышечных клеток. Ионная природа ПД гладкой мышцы определяется особенностями каналов мембраны гладкой мышечной клетки. Основную роль в механизме возникновения ПД играют ионы Са2+. Кальциевые каналы мембраны гладких мышечных клеток пропускают не только ионы Са2+, но и другие двухзарядные ионы (Bа 2+, Mg2+), а также Na+. Вход Са2+ в клетку во время ПД необходим для поддержания тонуса и развития сокращения, поэтому блокирование кальциевых каналов мембраны гладких мышц, приводящее к ограничению поступления иона Са2+ в цитоплазму миоцитов внутренних органов и сосудов, широко используется в практической медицине для коррекции моторики пищеварительного тракта и тонуса сосудов при лечении больных гипертонической болезнью.
Автоматия. ПД гладких мышечных клеток имеют авторитмический (пейсмекерный) характер, подобно потенциалам проводящей системы сердца. Пейсмекерные потенциалы регистрируются в различных участках гладкой мышцы. Это свидетельствует о том, что любые клетки висцеральных гладких мышц способны к самопроизвольной автоматической активности. Автоматия гладких мышц, т.е. способность к автоматической (спонтанной) деятельности, присуща многим внутренним органам и сосудам.
Реакция на растяжение. Уникальной особенностью висцеральной гладкой мышцы является ее реакция на растяжение. В ответ на растяжение гладкая мышца сокращается. Это вызвано тем, что растяжение уменьшает мембранный потенциал клеток, увеличивает частоту ПД и в конечном итоге — тонус гладкой мускулатуры. В организме человека это свойство гладкой мускулатуры служит одним из способов регуляции двигательной деятельности внутренних органов. Например, при наполнении желудка происходит растяжение его стенки. Увеличение тонуса стенки желудка в ответ на его растяжение способствует сохранению объема органа и лучшему контакту его стенок с поступившей пищей. В кровеносных сосудах растяжение, создаваемое колебаниями кровяного давления, является основным фактором миогенной саморегуляции тонуса сосудов. Наконец, растяжение мускулатуры матки растущим плодом служит одной из причин начала родовой деятельности.
Пластичность. Еще одной важной специфической характеристикой гладкой мышцы является изменчивость напряжения без закономерной связи с ее длиной. Так, если растянуть висцеральную гладкую мышцу, то ее напряжение будет увеличиваться, однако если мышцу удерживать в состоянии удлинения, вызванным растяжением, то напряжение будет постепенно уменьшаться, иногда не только до уровня, существовавшего до растяжения, но и ниже этого уровня. Это свойство называется пластичностью гладкой мышцы. Таким образом, гладкая мышцы более похожа на тягучую пластичную массу, чем на малоподатливую структурированную ткань. Пластичность гладкой мускулатуры способствует нормальному функционированию внутренних полых органов.
Связь возбуждения с сокращением. Изучать соотношения между электрическими и механическими проявлениями в висцеральной гладкой мышце труднее, чем в скелетной или сердечной, так как висцеральная гладкая мышца находится в состоянии непрерывной активности. В условиях относительного покоя можно зарегистрировать одиночный ПД. В основе сокращения как скелетной, так и гладкой мышцы лежит скольжение актина по отношению к миозину, где ион Са2+ выполняет триггерную функцию (рис. 2.31).
В механизме сокращения гладкой мышцы имеется особенность, отличающая его от механизма сокращения скелетной мышцы. Эта особенность заключается в том, что прежде чем миозин гладкой мышцы сможет проявлять свою АТФазную активность, он должен быть фосфорилирован. Фосфорилирование и дефосфорилирование миозина наблюдается и в скелетной мышце, но в ней процесс фосфорилирования не является обязательным для активации АТФазной активности миозина. Механизм фосфорилирования миозина гладкой мышцы осуществляется следующим образом: ион Са2+ соединяется с кальмодулином (кальмодулин — рецептивный белок для иона Са2+). Возникающий комплекс активирует фермент — киназу легкой цепи миозина, который в свою очередь катализирует процесс фосфорилирования миозина. Затем происходит скольжение актина по отношению к миозину, составляющее основу сокращения. Отметим, что пусковым моментом для сокращения гладкой мышцы является присоединение иона Са2+ к кальмодулину, в то время как в скелетной и сердечной мышце пусковым моментом является присоединение Са2+ к тропонину.
Химическая чувствительность. Гладкие мышцы обладают высокой чувствительностью к различным физиологически активным веществам: адреналину, норадреналину, АХ, гистамину и др. Это обусловлено наличием специфических рецепторов мембраны гладкомышечных клеток. Если добавить адреналин или норадреналин к препарату гладкой мышцы кишечника, то увеличивается мембранный потенциал, уменьшается частота ПД и мышца расслабляется, т. е. наблюдается тот же эффект, что и при возбуждении симпатических нервов.
|
|
|
Рис. 2.31. Механизмы активации и расслабления гладких мышц кишечника. А — волна деполяризации и пиковые потенциалы действия под влиянием растяжения и при действии ацетилхолина, приводящие к сокращению гладкой мышцы; Б — гиперполяризация мембраны миоцитов при действии норадреналина, приводящая к расслаблению гладкой мышцы; 1 — мембранный потенциал гладкомышечных клеток; 2 — уровень напряжения гладкой мышцы. |
Норадреналин действует на α- и β-адренорецепторы мембраны гладкомышечных клеток. Взаимодействие норадреналина с β-рецепторами уменьшает тонус мышцы в результате активации аденилатциклазы и образования циклического АМФ и последующего увеличения связывания внутриклеточного Са2+. Воздействие норадреналина на α-рецепторы тормозит сокращение за счет увеличения выхода ионов Са2+ из мышечных клеток.
АХ оказывает на мембранный потенциал и сокращение гладкой мускулатуры кишечника действие, противоположное действию норадреналина. Добавление АХ к препарату гладкой мышцы кишечника уменьшает мембранный потенциал и увеличивает частоту спонтанных ПД. В результате увеличивается тонус и возрастает частота ритмических сокращений, т. е. наблюдается тот же эффект, что и при возбуждении парасимпатических нервов. АХ деполяризует мембрану, увеличивает ее проницаемость для Na+ и Са+.
Гладкие мышцы некоторых органов реагируют на различные гормоны. Так, гладкая мускулатура матки у животных в периоды между овуляцией и при удалении яичников относительно невозбудима. Во время течки или у животных, лишенных яичников, которым вводился эстроген, возбудимость гладкой мускулатуры возрастает. Прогестерон увеличивает мембранный потенциал еще больше, чем эстроген, но в этом случае электрическая и сократительная активность мускулатуры матки затормаживается.
2.5. ФИЗИОЛОГИЯ ЖЕЛЕЗИСТОЙ ТКАНИ
Классическими клеточными элементами возбудимых тканей (нервной и мышечной) являются нейроны и миоциты. Железистая ткань также относится к возбудимым, но образующие ее гландулоциты обладают существенной морфофункциональной спецификой.
2.5.1. Секреция
Секреция — процесс образования внутри клетки (гландулоцита) из веществ, поступивших в нее, и выделения из клетки специфического продукта (секрета) определенного функционального назначения. Гландулоциты могут быть представлены отдельными клетками и объединены в составе экзокринных и эндокринных желез.
Функциональное состояние желез определяют по количеству и качеству их экзосекретов (например, пищеварительных, потовых и др.) и содержанию инкретируемых железами продуктов в крови и лимфе. Реже для этого используют методы отведения и регистрации секреторных потенциалов с поверхности тела и слизистых оболочек; применяют также регистрацию потенциалов желез, их фрагментов и отдельных гландулоцитов; кроме того, распространены морфологические, в том числе гисто- и цитохимические методы исследования секреторной функции различных желез.
Гландулоциты выделяют различные по химической природе продукты: белки, липопротеиды, мукополисахариды, растворы солей, оснований и кислот. Секреторная клетка может синтезировать и выделять один или несколько секреторных продуктов одной либо разной химической природы. Выделяемый секреторной клеткой материал может иметь различное отношение к внутриклеточным процессам. Принято считать собственно секретом продукт метаболизма данной клетки, экскретом — продукт ее катаболизма, рекретом — поглощенный клеткой из крови и затем в неизмененном виде выделенный продукт. Секрет может выводиться из клетки через ее апикальную мембрану в просвет ацинусов, протоки желез, полость пищеварительного тракта — внешняя секреция, или экзосекреция. Выведение секрета из клетки через ее базолатеральную мембрану в интерстициальную жидкость, откуда он поступает в кровь и лимфу, называется внутренней секрецией — эндосекрецией, или инкрецией.
Экзо- и эндосекреция имеют много общего на уровне синтеза и выделения секреторного продукта. Выделение секретов из клетки может осуществляться двумя способами, поэтому в крови можно обнаружить продукты экзосекреторных желез (например, ферменты пищеварительных желез), а в экзосекретах — гормоны (в секретах пищеварительных желез находят небольшое количество гормонов). В составе некоторых желез (например, поджелудочной) имеются экзокринные и эндокринные клетки. Эти явления находят объяснение в экскреторной теории происхождения секреторных процессов (А. М. Уголев). Согласно этой теории, внешняя и внутренняя секреция желез произошла от свойственной всем клеткам неспецифической функции — экскреции — выделения из них продуктов обмена веществ.
2.5.2. Многофункциональность секреции
В процессе экзо- и эндосекреции реализуется несколько функций. Так, в результате внешней секреции желез пищеварительного тракта в него выделяются растворы ферментов и электролитов, обеспечивающие переваривание пищи в созданных ими оптимальных физико-химических условиях. Секреция потовых желез выступает в роли важного механизма терморегуляции (см. главу 11). Секреция молочных желез необходима для лактотрофного питания детей (см. раздел 13.5). Экзосекреция желез играет большую роль в поддержании относительного постоянства внутренней среды организма, обеспечивая выделение из организма эндогенных и экзогенных веществ (см. главу 12). Экзосекретируемые в полость пищеварительного тракта продукты (ионы Н+, ферменты и др.) принимают участие в регуляции пищеварительных функций (см. главу 9). Секретируемая мукоцитами слизь выполняет защитную роль, ограждая слизистые оболочки от чрезмерных механических и химических раздражений. В составе секретов выделяются вещества, необходимые для иммунной защиты организма.
Продукты внутренней секреции выполняют роль гуморальных регуляторов обмена веществ и функций. Особенно велика в этом роль специфических гормонов (см. главу 5). Ферменты, вырабатываемые и инкретируемые различными железами, участвуют в тканевом гидролизе питательных веществ, формировании защитных гистогематических барьеров, образовании физиологически активных веществ (например, регуляторных пептидов из белков), в других физиологических процессах (например, свертывании крови и фибринолизе). Примеры функции секретов будут дополнены в соответствующих главах.
Секреторным циклом называется периодическое изменение состояния секреторной клетки, обусловленное образованием, накоплением, выделением секрета и восстановлением ее дальнейшей секреции. В секреторном цикле выделяют несколько фаз: поступление в клетку исходных веществ (ведущее значение в этом имеют диффузия, активный транспорт и эндоцитоз), синтез и транспорт исходного секреторного продукта, формирование секреторных гранул, выделение секрета из клетки — экзоцитоз. Из клетки выделяются и негра-нулированные продукты секреции. Существуют клетки с разными типами внутриклеточных процессов и видами выделения секретов. В зависимости от типа выделения секрета секрецию делят на голокриновую, апокриновую (макро- и микро-) и мерокриновую двух видов в зависимости от механизма выхода секрета через апикальную мембрану: секрет покидает гландулоцит через отверстия, образующиеся при контакте с ней секреторной гранулы в апикальной мембране, или через мембрану, не меняющую свою структуру.
2.5.4. Биопотенциалы гландулоцитов
Биопотенциалы секреторных клеток имеют ряд особенностей в покое и при секреции: низкую величину и скорость изменения, градуальность, различную поляризованность базальной и апикальной мембран, гетерохронность изменения поляризованности мембраны при секреции и др.
Мембранный потенциал гландулоцитов различных экзокринных желез в состоянии относительного покоя равен от —30 до —75 мВ. Стимуляция секреции меняет мембранный потенциал. Это изменение поляризованности мембраны называется секреторным потенциалом. У разных гландулоцитов он имеет существенные различия, характеризует секреторный процесс, влияет на секреторный цикл и сопряжение его фаз, синхронизацию активности гландулоцитов в составе данной железы (это не исключает химического взаимодействия их через межклеточные контакты). Оптимальной для возникновения секреторных потенциалов считается поляризованность мембран, равная —50 мВ.
Для возбуждения большинства видов гландулоцитов характерна деполяризация их мембран, но описаны гландулоциты, при возбуждении которых мембраны гиперполяризуются, формируя двухфазные потенциалы. Деполяризация мембраны обусловлена потоком ионов Na+ в клетку и выходом из нее ионов К+. Гиперполяризация мембраны обусловлена транспортом в клетку ионов Сl- и выходом из нее ионов Na+ и К+. Различие в поляризованности базальной и апикальной мембран составляет 2—3 мВ, что создает значительное электрическое поле (20—30 В/см). Его напряженность при возбуждении секреторной клетки возрастает примерно вдвое, что способствует перемещению секреторных гранул к апикальному полюсу клетки и выходу секреторного материала из клетки.
Физиологические стимуляторы секреции, повышающие концентрацию Са2+ в гландулоцитах, влияют на калиевые и натриевые каналы и вызывают секреторный потенциал. Ряд стимуляторов секреции, действующих через активацию аденилатциклазы и не влияющих на обмен ионов Са2+ в гландулоцитах, не вызывает в них электрических эффектов. Следовательно, изменение мембранного потенциала и электрической проводимости гландулоцитов опосредовано увеличением внутриклеточной концентрации кальция.
2.5.5. Регуляция секреции гландулоцитов
Секреция желез контролируется нервными, гуморальными и паракринными механизмами. В результате действия этих механизмов происходят возбуждение, торможение и модуляция секреции гландулоцитов. Эффект зависит от типа эфферентных нервов, медиаторов, гормонов и других физиологически активных веществ, вида гландулоцитов, входящих в состав железистой ткани, мембранных рецепторов на них, механизма действия этих веществ на внутриклеточные процессы. Для синаптических окончаний на гландулоцитах характерны незамкнутые относительно широкие синаптические щели, заполненные интерстициальной жидкостью. Сюда из окончаний нейронов поступают медиаторы, из крови — гормоны, из соседних эндокринных клеток — парагормоны, от самих гландулоцитов — продукты их деятельности.
Медиаторы и гормоны (первичные мессенджеры, или передатчики) взаимодействуют с рецепторами базолатеральной мембраны гландулоцита. Возникающий при этом сигнал передается на локализованную на внутренней стороне мембраны аденилатциклазу, в результате чего повышается или понижается ее активность, соответственно увеличивается или уменьшается образование циклического аденозинмонофосфата цАМФ. Аналогично развивается процесс с гуанилатциклазой и циклическим гуанилмонофосфатом цГМФ. Эти циклические нуклеотиды, выполняя роль вторичных передатчиков (мессенджеров), влияют на цепь внутриклеточных ферментативных реакций, характерных для данного вида гландулоцитов, через взаимодействие с протеинкиназой.
Кроме того, влияния вторичных мессенджеров осуществляются системой кальций — кальмодулин, в которой ионы Са2+ имеют внутри- и внеклеточное происхождение, и активация секреции зависит от концентрации кальция и кальмодулина.
Гландулоциты в состоянии относительного покоя выделяют небольшое количество секрета, которое может градуально усиливаться и уменьшаться. На мембранах гландулоцитов имеются возбуждающие и тормозные рецепторы, с участием которых секреторная активность гландулоцитов изменяется в широких пределах.
Некоторые вещества изменяют деятельность гландулоцитов, проникая в них через базолатеральную мембрану. Таким образом, продукты секреции сами тормозят секреторную активность гландулоцитов по принципу отрицательной обратной связи.