Рис. 5.1. Регуляция уровня гормона в крови по механизму обратной связи. Объяснение в тексте.
Г л а в а 5. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ
5.1. ПРИНЦИПЫ ГОРМОНАЛЬНОЙ РЕГУЛЯЦИИ
Все процессы жизнедеятельности организма строго согласованы между собой по скорости, времени и месту протекания. В организме человека эту согласованность осуществляют внутриклеточные и межклеточные механизмы регуляции, важнейшую роль в которых играют гормоны и нейромедиаторы. Специфические регуляторы, которые секретируются эндокринными железами в кровь или лимфу, а затем попадают на клетки-мишени, называют гормонами. Вещества, которые выделяются из пресинаптических нервных окончаний в синаптическую щель и вызывают биологический эффект, связываясь с рецепторами постсинаптической мембраны, называют нейромедиаторами.
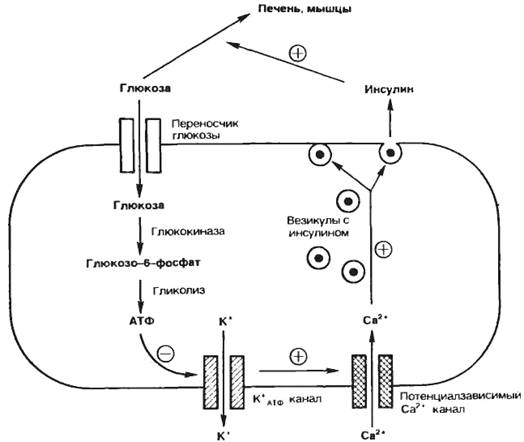
Функциональная активность эндокринной железы может регулироваться «субстратом», на который направлено действие гормона. Так, глюкоза стимулирует секрецию инсулина из β-клеток панкреатических островков (островки Лангерганса), а инсулин понижает концентрацию глюкозы в крови, активируя ее транспорт в мышцы и печень. Это происходит следующим образом. Глюкоза входит в β-клетки поджелудочной железы через переносчик глюкозы и сразу же фосфорилируется глюкокиназой, после чего вовлекается в гликолиз. Образующийся при этом АТФ ингибирует калиевые каналы, вследствие чего снижается мембранный потенциал β-клеток и активируются потенциалзависимые кальциевые каналы. Входящий в β-клетку кальций стимулирует слияние везикул, содержащих инсулин, с плазматической мембраной и секрецию инсулина. Инсулин активирует перенос глюкозы в печень, сердце и скелетные мышцы, вследствие чего уровень глюкозы в крови снижается, замедляется ее вход в β-клетки и уменьшается секреция инсулина (рис. 5.1).
Такой же механизм лежит в основе секреции паратгормона (паратиреоидный гормон, паратирин) и кальцитонина. Оба гормона влияют на концентрацию кальция и фосфатов в крови. Паратиреоидный гормон вызывает выход минеральных веществ из кости и стимулирует реабсорбцию кальция в почках и кишечнике, в результате чего возрастает концентрация кальция в плазме крови. Кальцитонин, напротив, стимулирует поступление кальция и фосфатов в костную ткань, в результате чего концентрация минеральных веществ в крови снижается. При высокой концентрации кальция в крови подавляется секреция паратиреоидного гормона и стимулируется секреция кальцитонина. В случае снижения концентрации кальция в крови секреция паратиреоидного гормона усиливается, а кальцитонина — ослабляется.
|
|
|
Рис. 5.1. Регуляция уровня гормона в крови по механизму обратной связи. Объяснение в тексте. |
Такая регуляция постоянства внутренней среды организма, происходящая по принципу отрицательной обратной связи, очень эффективна для поддержания гомеостаза, однако не может выполнять все задачи адаптации организма. Например, кора надпочечников продуцирует стероидные гормоны в ответ на голод, болезнь, эмоциональное возбуждение и т. п. Чтобы эндокринная система могла «отвечать» на свет, звуки, запахи, эмоции и т. д., должна существовать связь между эндокринными железами и нервной системой.
Основные связи между нервной и эндокринной системами регуляции осуществляются посредством взаимодействия гипоталамуса и гипофиза (рис. 5.2). Нервные импульсы, приходящие в гипоталамус, активируют секрецию так называемых рилизинг-факторов (либеринов и статинов): тиреолиберина, соматолиберина, пролактолиберина, гонадолиберина и кортиколиберина, а также соматостатина и пролактостатина. Мишенью для либеринов и статинов, секретируемых гипоталамусом, является гипофиз. Каждый из либеринов взаимодействует с определенной популяцией клеток гипофиза и вызывает в них синтез соответствующих тропинов: тиреотропина, соматотропного гормона (соматотропин — гормон роста), пролактина, гонадотропного гормона, (гонадотропины — лютеинизирующий и фолликулостимулирующий), а также адренокортикотропного гормона (АКТГ, кортикотропин). Статины оказывают на гипофиз влияние, противоположное действию либеринов, — подавляют секрецию тропинов. Тропины, секретируемые гипофизом, поступают в общий кровоток и, попадая на соответствующие железы, активируют в них секреторные процессы.
|
|
|
Рис. 5.2. Регуляция активности эндокринных желез центральной нервной системой при участии гипоталамуса и гипофиза. ТЛ — тиреолиберин; СЛ — соматалиберин; СС — соматостатин; ПЛ — пролактолиберин; ГЛ — гонадолиберин; КЛ — кортиколиберин; ТТГ — тиреотропный гормон; СТГ — соматотропный гормон (гормон роста); Пр — пролактин; ФСГ — фолликулостимулирующий гормон; ЛГ — лютеиниэирующий гормон; АКТГ — адренокортикотропный гормон. Сплошными стрелками обозначено активирующее, пунктирными — ингибирующее влияние. |
Молекула соматолиберина является самой крупной среди либеринов, она состоит из 15 аминокислотных остатков; самая маленькая молекула — трипептид — у тиреолиберина. Молекулы тропинов, образующихся в гипофизе, содержат от 13 до 198 аминокислотных остатков.
Регуляция деятельности гипофиза и гипоталамуса, кроме сигналов, идущих «сверху вниз», осуществляется гормонами «исполнительных» желез (рис. 5.3). Эти «обратные» сигналы поступают в гипоталамус и затем передаются в гипофиз, что приводит к изменению секреции соответствующих тропинов. После удаления или атрофии эндокринной железы стимулируется секреция соответствующего тропного гормона; при гиперфункции железы секреция соответствующего тропина подавляется.
|
|
|
Рис. 5.3. Прямые и обратные связи в нейроэндокринной системе регуляции. 1 — медленно развивающееся и продолжительное ингибирование секреции гормонов и нейромедиаторов, а также изменение поведения и формирование памяти; 2 — быстро развивающееся, но продолжительное ингибирование; 3 — кратковременное ингибирование. |
Обратные связи не только позволяют регулировать концентрацию гормонов в крови, но и участвуют в дифференцировке гипоталамуса в онтогенезе. Образование половых гормонов в женском организме происходит циклически, что объясняется циклической секрецией гонадотропных гормонов. Синтез этих гормонов контролируется гипоталамусом, образующим рилизинг-фактор этих тропинов (гонадолиберин). Если самке пересадить гипофиз самца, то пересаженный гипофиз начинает функционировать циклично. Половая дифференцировка гипоталамуса происходит под действием андрогенов. Если самца лишить половых желез, продуцирующих андрогены, то гипоталамус будет дифференцироваться по женскому типу.
В железах внутренней секреции иннервированы, как правило, только сосуды, а эндокринные клетки изменяют свою биосинтетическую и секреторную активность лишь под действием метаболитов, кофакторов и гормонов, причем не только гипофизарных. Так, ангиотензин II стимулирует синтез и секрецию альдостерона. Отметим также, что некоторые гормоны гипоталамуса и гипофиза могут образовываться не только в этих тканях. Например, соматостатин (гормон гипоталамуса, ингибирующий образование и секрецию гормона роста) обнаружен также в поджелудочной железе, где он подавляет секрецию инсулина и глюкагона.
Большинство нервных и гуморальных путей регуляции сходится на уровне гипоталамуса и благодаря этому в организме образуется единая нейроэндокринная регуляторная система. К клеткам гипоталамуса подходят аксоны нейронов, расположенных в коре больших полушарий и подкорковых образованиях. Эти аксоны секретируют различные нейромедиаторы, оказывающие на секреторную активность гипоталамуса как активирующее, так и тормозное влияние. Поступающие из мозга нервные импульсы гипоталамус «превращает» в эндокринные стимулы, которые могут быть усилены или ослаблены в зависимости от гуморальных сигналов, поступающих в гипоталамус от желез и тканей, подчиненных ему.
Тропины, образующиеся в гипофизе, не только регулируют деятельность подчиненных желез, но и выполняют самостоятельные эндокринные функции. Например, пролактин оказывает лактогенное действие, а также тормозит процессы дифференцировки клеток, повышает чувствительность половых желез к гонадотропинам, стимулирует родительский инстинкт. Кортикотропин является не только стимулятором стероцдогенеза, но и активатором липолиза в жировой ткани, а также важнейшим участником процесса превращения в мозге кратковременной памяти в долговременную. Гормон роста может стимулировать активность иммунной системы, обмен липидов, Сахаров и т. д.
В задней доле гипофиза (нейрогипофиз) депонируются антидиуретический гормон (вазопрессин) и окситоцин (см. рис. 5.3). Первый вызывает задержку воды в организме и повышает тонус сосудов, второй стимулирует сокращение матки при родах и секрецию молока. Оба гормона синтезируются в гипоталамусе, затем транспортируются по аксонам в заднюю долю гипофиза, где депонируются и потом секретируются в кровь.
Характер процессов, протекающих в ЦНС, во многом определяется состоянием эндокринной регуляции. Так, андрогены и эстрогены формируют половой инстинкт, многие поведенческие реакции. Очевидно, что нейроны, точно так же как и другие клетки нашего организма, находятся под контролем гуморальной системы регуляции. Нервная система, эволюционно более поздняя, имеет как управляющие, так и подчиненные связи с эндокринной системой. Эти две регуляторные системы дополняют друг друга, образуют функционально единый механизм, что обеспечивает высокую эффективность нейрогуморальной регуляции, ставит ее во главе систем, согласующих все процессы жизнедеятельности в многоклеточном организме.
5.2. ЖЕЛЕЗЫ ВНУТРЕННЕЙ СЕКРЕЦИИ
Железами внутренней секреции, или эндокринными железами, являются специализированные органы, которые выделяют образующиеся в них продукты секреции непосредственно в кровь или тканевую жидкость. В настоящее время к эндокринным железам относят гипофиз, щитовидную железу, околощитовидные железы, корковое и мозговое вещество надпочечников, островковый аппарат поджелудочной железы, половые железы, тимус, и эпифиз. Эндокринной активностью обладает также плацента. Кроме того, эндокринные клетки могут присутствовать в некоторых других органах и тканях, в частности в пищеварительном тракте, почках, сердечной мышце, вегетативных ганглиях. Эти клетки образуют так называемую диффузную эндокринную систему. Общей функцией для всех желез внутренней секреции является выработка гормонов. Термин «гормон» происходит от греческого слова hormae, что означает «возбуждаю, побуждаю». Первыми веществами, которые получили название гормонов, были секретин и гастрин; их открытие произошло соответственно в 1902 и 1905 гг. К настоящему времени открыто несколько десятков гормонов.
Для изучения функций желез внутренней секреции используются различные экспериментальные и клинические методы исследования. К наиболее важным из них следует отнести следующие.
1. Изучение последствий удаления (экстирпации) эндокринных желез. После удаления какой-либо эндокринной железы возникает комплекс расстройств, обусловленных выпадением регуляторных эффектов тех гормонов, которые вырабатываются в этой железе. Например, предположение о наличии эндокринных функций у поджелудочной железы нашло подтверждение в опытах И. Меринга и О. Минковского (1889), показавших, что ее удаление у собак приводит к выраженной гипергликемии и глюкозурии; животные погибали в течение 2—3 нед. после операции на фоне явлений тяжелого сахарного диабета. В последующем было установлено, что эти изменения возникают из-за недостатка инсулина — гормона, образующегося в островковом аппарате поджелудочной железы.
Вследствие травматичности оперативного вмешательства вместо хирургического удаления эндокринной железы может быть использовано введение химических веществ, нарушающих их гормональную функцию. Например, введение животным аллоксана нарушает функцию β-клеток поджелудочной железы, что приводит к развитию сахарного диабета, проявления которого практически идентичны расстройствам, наблюдаемым после экстирпации поджелудочной железы.
2. Наблюдение эффектов, возникших при имплантации желез. У животного с
удаленной эндокринной железой можно ее имплантировать заново в хорошо
васкуляризированную область тела, например под капсулу почки или в переднюю
камеру глаза. Такая операция называется реимплантацией. Для ее проведения обычно
используют эндокринную железу, полученную от животного-донора. После
реимплантации постепенно восстанавливается уровень гормонов в крови, что
приводит к исчезновению нарушений, возникших ранее в результате дефицита этих
гормонов в организме. Например,
Бертольдом (1849) было показано, что у
петухов пересадка половых желез в брюшную полость после кастрации предотвращает
развитие посткастрационного синдрома. Возможна также пересадка
эндокринной железы животному, у которого операция экстирпации ранее не
производилась. Последнее может быть использовано для изучения эффектов,
возникающих при избытке гормона в крови, так как его секреция в данном случае
осуществляется не только собственной эндокринной железой животного, но и
имплантированной.
3. Изучение эффектов, возникших при введении экстрактов эндокринных желез. Нарушения, возникшие после хирургического удаления эндокринной железы, могут быть откорректированы посредством введения в организм достаточного количества экстракта данной железы или индивидуального гормона.
4. Использование радиоактивных изотопов. Иногда для исследования
функциональной активности эндокринной железы, может быть использована ее
способность захватывать из крови и накапливать определенное соединение.
Известно, например, что щитовидная железа активно поглощает йод, который затем
используется для синтеза тироксина и трийодтиронина. При гиперфункции щитовидной
железы накопление йода усиливается, при гипофункции наблюдается обратный эффект.
Интенсивность накопления йода может быть определена путем введения в организм
радиоактивного изотопа 131I с
последующей оценкой радиоактивности
щитовидной железы. В качестве радиоактивной метки могут быть введены также
соединения, которые используются для синтеза эндогенных гормонов и
включаются в их структуру. В последующем можно определить радиоактивность
различных органов и тканей и оценить, таким образом, распределение гормона в
организме, а также найти его органы-мишени.
Определение количественного содержания гормона. В ряде случаев для выяснения механизма какого-либо физиологического эффекта целесообразно сопоставить его динамику с изменением количественного содержания гормона в крови или в другом исследуемом материале.
К наиболее современным относятся методы радиоиммунологического определения концентрации гормонов в крови. Эти методы основаны на том, что меченный радиоактивной меткой гормон и гормон, содержащийся в исследуемом материале, конкурируют между собой за связывание со специфическими антителами: чем больше в биологическом материале содержится данного гормона, тем меньше свяжется меченых молекул гормона, так как количество гормонсвязывающих участков в образце постоянно.
6. Важное значение для понимания регуляторных функций желез внутренней секреции и диагностики эндокринной патологии имеют клинические методы исследования. К ним относятся диагностика типичных симптомов избытка или недостатка того или иного гормона, использование различных функциональных проб, рентгенологические, лабораторные и другие методы исследования.
В гипофизе выделяют переднюю (аденогипофиз) и заднюю (нейрогипофиз) доли. У многих животных представлена также промежуточная доля (pars intermedia), однако у человека она практически отсутствует. В аденогипофизе вырабатывается 6 гормонов, из них 4 являются тропными (адренокортикотропный гормон, или кортикотропин, тиреотропный гормон, или тиреотропин и 2 гонадотропина — фолликулостимулирующий и лютеинизирующий гормоны), а 2 — эффекторными (соматотропный гормон, или соматотропин, и пролактин). в нейрогипофизе происходит депонирование окситоцина и антидиуретического гормона (вазопрессин). Синтез этих гормонов осуществляется в супраоптическом и паравентрикулярном ядрах гипоталамуса. Нейроны, составляющие эти ядра, имеют длинные аксоны, которые в составе ножки гипофиза образуют гипоталамо-гипофизарный тракт и достигают задней доли гипофиза. Синтезированные в гипоталамусе окситоцин и вазопрессин доставляются в нейрогипофиз путем аксонального транспорта с помощью специального белка-переносчика, получившего название «нейрофизин».
Гормоны аденогипофиза. Адренокортикотропный гормон, или кортикотропин. Основной эффект этого гормона выражается в стимулирующем действии на образование глюкокортикоидов в пучковой зоне коркового вещества надпочечников. В меньшей степени выражено влияние гормона на клубочковую и сетчатую зоны. Кортикотропин ускоряет стероидогенез и усиливает пластические процессы (биосинтез белка, нуклеиновых кислот), что приводит к гиперплазии коркового вещества надпочечников. Оказывает также вненадпочечниковое действие, проявляющееся в стимуляции процессов липолиза, анаболическом влиянии, усилении пигментации. Влияние на пигментацию обусловлено частичным совпадением аминокислотных цепей кортикотропина и меланоцитостимулирующего гормона.
Выработка кортикотропина регулируется кортиколиберином гипоталамуса.
Тиреотропный гормон, или тиреотропин. Под влиянием тиреотропина стимулируется образование в щитовидной железе тироксина и трийодтиронина. Тиреотропин увеличивает секреторную активность тиреоцитов за счет усиления в них пластических процессов (синтез белка, нуклеиновых кислот) и увеличенного поглощения кислорода. В результате ускоряются практически все стадии биосинтеза гормонов щитовидной железы. Под влиянием тиреотропина активируется работа «йодного насоса», усиливаются процессы йодирования тирозина. Кроме того, увеличивается активность протеаз, расщепляющих тиреоглобулин, что способствует высвобождению активного тироксина и трийодтиронина в кровь.Выработка тиреотропина регулируется тиреолиберином гипоталамуса.
Гонадотропные гормоны, или гонадотропины. В аденогипофизе вырабатывается 2 гонадотропина — фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГУ). ФСГ действует на фолликулы яичников, ускоряя их созревание и подготовку к овуляции. Под влиянием ЛГ происходит разрыв стенки фолликула (овуляция) и образуется желтое тело. ЛГ стимулирует выработку прогестерона в желтом теле. Оба гормона влияют также на мужские половые железы. ЛГ действует на яички, ускоряя выработку тестостерона в интерстициальных клетках — гландулоцитах (клетки Лейдига).ФСГ действует на клетки семенных канальцев, усиливая в них процессы сперматогенеза. Регуляция секреции гонадотропинов осуществляется гипоталамическим гонадолиберином. Существенное значение имеет также механизм отрицательной обратной связи — секреция обоих гормонов тормозится при повышенном содержании эстрогенов и прогестерона в крови; выработка ЛГ уменьшается при увеличении продукции тестостерона.
Соматотропный гормон, или соматотропин. Является гормоном, специфическое действие которого проявляется в усилении процессов роста и физического развития. Органами-мишенями для него являются кости, а также образования, богатые соединительной тканью, — мышцы, связки, сухожилия, внутренние органы. Стимуляция процессов роста осуществляется за счет анаболического действия соматотропина. Последнее проявляется в усилении транспорта аминокислот в клетку, ускорении процессов биосинтеза белка и нуклеиновых кислот. Одновременно происходит торможение реакций, связанных с распадом белка. Вероятной причиной этого эффекта является наблюдающаяся под действием соматотропина усиленная мобилизация жира из жировых депо с последующим использованием жирных кислот в качестве основного источника энергии. В связи с этим определенное количество белка сберегается от энергетических трат, поэтому скорость катаболизма белков снижается. Поскольку в этой ситуации процессы синтеза белка преобладают над процессами его распада, в организме происходит задержка азота (положительный азотистый баланс). Благодаря анаболическому действию соматотропин стимулирует активность остеобластов и способствует интенсивному образованию белковой матрицы кости. Кроме того, усиливаются также процессы минерализации костной ткани, в результате чего в организме происходит задержка кальция и фосфора.
Несмотря на то, что в организме соматотропин активно стимулирует образование костной и хрящевой ткани, при введении данного гормона в изолированную культуру клеток заметного усиления роста последних обычно не наблюдается. В связи с этим возникло предположение, что стимуляция процессов роста, наблюдаемая в условиях целостного организма, не является результатом прямого действия этого гормона. Скорее всего под действием соматотропина происходит образование определенных посредников, влияние которых и приводит к анаболическому эффекту. Данные посредники получили название «соматомедины». К настоящему времени идентифицировано по крайней мере 4 различных соматомедина. Все они по своей химической структуре являются белками, образование которых происходит в печени под влиянием соматотропина. Показано, что нарушение синтеза соматомединов может приводить к задержке роста и физического развития, хотя концентрация соматотропина в плазме крови при этом может оставаться нормальной или даже повышенной. Влияние соматомединов на углеводный обмен соответствует эффектам, наблюдаемым при введении инсулина, поэтому их называют также «инсулиноподобные факторы роста».
Соматотропин обладает выраженным действием на углеводный. обмен. Под влиянием данного гормона увеличивается содержание глюкозы в плазме крови. Механизм данного эффекта имеет несколько объяснений. Прежде всего тормозится использование глюкозы на энергетические траты, поскольку, как указывалось выше, основным источником энергии в данных условиях являются жирные кислоты. Кроме того, гормон роста тормозит утилизацию глюкозы в тканях и снижает их чувствительность к действию инсулина. Под влиянием соматотропина увеличивается также активность фермента инсулиназы. Этот гормон обладает «диабетогенным» эффектом. Наблюдаемая при его введении гипергликемия является стимулом для выработки инсулина β-клетками поджелудочной железы. Выработка инсулина увеличивается также и за счет прямого стимулирующего влияния соматотропина на β-клетки. В результате может произойти истощение их секреторной функции, которое в сочетании с повышенной активностью инсулиназы приводит к развитию так называемого гипофизарного диабета.
Секреция гормона роста регулируется соматолиберином и соматостатином, которые вырабатываются в гипоталамусе. Отмечено усиление выработки соматотропина при стрессорных воздействиях, истощении запасов белка в организме. Увеличение секреции происходит также при сниженном содержании глюкозы и жирных кислот в плазме крови.
Пролактин. Эффекты этого гормона заключаются в следующем:
1) усиливаются пролиферативные процессы в молочных железах, и ускоряется их рост;
2) усиливаются процессы образования и выделения молока. Секреция пролактина возрастает во время беременности и стимулируется рефлекторно при кормлении грудью. Благодаря специфическому действию на молочную железу пролактин называют маммотропным гормоном;
3) увеличивается реабсорбция натрия и воды в почках, что имеет значение для образования молока. В этом отношении он является синергистом альдостерона;
4) стимулируются образование желтого тела и выработка им прогестерона.
Продукция пролактина регулируется посредством выработки в гипоталамусе пролактостатина и пролактолиберина.
Гормоны нейрогипофиза. Антидиуретический гормон (АДГ). В общем виде действие АДГ сводится к двум основным эффектам:
1) стимулируется реабсорбция воды в дистальных канальцах почек. В результате
увеличивается объем циркулирующей крови, повышается АД, снижается диурез и
возрастает относительная плотность мочи. В результате усиленного обратного
всасывания воды снижается осмотическое давление межклеточной жидкости. Под
действием АДГ происходит активация фермента аденилатциклазы, локализующегося на
поверхности базолатеральной (обращенной к интерстицию) мембраны клеток эпителия
почечных канальцев. Активация аденилатциклазы приводит к накоплению в
цитоплазме этих клеток цАМФ. Последний диффундирует в область апикальной
(обращенной в просвет почечного канальца) мембраны и стимулирует
образование в цитоплазме белковых везикул, которые затем включаются в
структуру апикальной мембраны и образуют в ней каналы, высокопроницаемые для
воды. В результате вода из просвета почечных канальцев поступает в
цитоплазму клеток эпителия канальцев, перемещается к базолатеральной
мембране и, проникая через нее, попадает в интерстициальную ткань. После
разрушения АДГ белковые везикулы элиминируются из структуры апикальной
мембраны. В результате этого последняя становится непроницаемой
для
воды;
2) в больших дозах АДГ вызывает сужение артериол, что приводит к увеличению АД. Развитию гипертензии способствует также наблюдающееся под влиянием АДГ повышение чувствительности сосудистой стенки к констрикторному действию катехоламинов. В связи с тем, что введение АДГ приводит к повышению АД, этот гормон получил также название «вазопрессин». Однако поскольку эффект вазоконстрикции возникает только при действии больших доз АДГ, то считают, что в физиологических условиях значимость его вазоконстрикторного влияния невелика. С другой стороны, развитие вазоконстрикции может иметь существенное адаптивное значение при некоторых патологических состояниях, например при острой кровопотере, сильных болевых воздействиях, поскольку в этих условиях в крови может присутствовать большое количество АДГ.
Основная часть АДГ синтезируется в супраоптическом ядре гипоталамуса (примерно 5/6 от общего количества), меньшая часть — в паравентрикулярном ядре. Секреция этого гормона усиливается при повышении осмотического давления крови. Последнее можно продемонстрировать путем введения гипертонического раствора в сосуды, питающие гипоталамус. В этом случае происходит раздражение осморецепторов, что приводит к увеличению выработки гормона в супраоптическом и паравентрикулярном ядрах и повышенной его секреции из задней доли гипофиза в кровь. Важным стимулом для регуляции секреции АДГ является также изменение объема циркулирующей крови. Показано, что при снижении последнего на 15—20% количество образующегося АДГ может увеличиваться в несколько десятков раз. В этом случае интенсивность секреции гормона меняется в зависимости от характера информации, поступающей в гипоталамус от волюморецепторов, реагирующих на растяжение кровью и локализующихся в правом предсердии, и барорецепторов, расположенных в аортальной и синокаротидной зонах, а также в легочной артерии.
Недостаточная секреция АДГ приводит к развитию несахарного мочеизнурения (diabetes insipidus), основными проявлениями которого являются сильная жажда (полидипсия) и потеря большого количества жидкости с выделяемой мочой (полиурия). Наблюдается учащенное мочеиспускание (поллакиурия), в результате которого больной за сутки выделяет до 10—20 л мочи низкой относительной плотности. Симптомы этого заболевания проходят при введении синтетического вазопрессина или препаратов, приготовленных из задней доли гипофиза животных.
Окситоцин. Эффекты этого гормона реализуются главным образом в двух направлениях:
1) окситоцин вызывает сокращение гладкой мускулатуры матки. Установлено, что при удалении гипофиза у животных родовые схватки становятся длительными и малоэффективными. Таким образом, окситоцин является гормоном, обеспечивающим нормальное протекание родового акта (отсюда произошло и его название — от лат. oxy — сильный, tokos — роды). Адекватное проявление этого эффекта возможно при условии достаточной концентрации в крови эстрогенов, которые усиливают чувствительность матки к окситоцину;
2) окситоцин принимает участие в регуляции процессов лактации. Он усиливает сокращение миоэпителиальных клеток в молочных железах и тем самым способствует выделению молока.
Содержание окситоцина в крови возрастает в конце беременности, в послеродовом периоде. Кроме того, его продукция стимулируется рефлекторно при раздражении соска в процессе грудного вскармливания.
Основной структурно-функциональной единицей щитовидной железы являются фолликулы. Они представляют собой округлые полости, стенка которых образована одним рядом клеток кубического эпителия. Фолликулы заполнены коллоидом и содержат гормоны тироксин и трийодтиронин, которые связаны с белком тиреоглобулином. В межфолликулярном пространстве проходят капилляры, обеспечивающие обильную васкуляризацию фолликулов. В щитовидной железе объемная скорость кровотока выше, чем в других органах и тканях. В межфолликулярном пространстве находятся также парафолликулярные клетки (С-клетки), в которых вырабатывается гормон тиреокальцитонин.
Биосинтез тироксина и трийодтиронина осуществляется за счет йодирования аминокислоты тирозина, поэтому в щитовидной железе происходит активное поглощение йода. Содержание йода в фолликулах в 30 раз превышает его концентрацию в крови, а при гиперфункции щитовидной железы это соотношение становится еще больше. Поглощение йода осуществляется за счет активного транспорта. После соединения тирозина, входящего в состав тиреоглобулина, с атомарным йодом образуются монойодтирозин и дийодтирозин. За счет соединения 2 молекул дийодтирозина образуется тироксин; конденсация моно- и дийодтирозина приводит к образованию трийодтиронина. В дальнейшем за счет действия протеаз, расщепляющих тиреоглобулин, происходит высвобождение в кровь активных гормонов.
Активность тироксина в несколько раз меньше, чем трийодтиронина. Кроме того, эффекты трийодтиронина имеют меньший латентный период, поэтому его действие развивается значительно быстрее. С другой стороны, содержание тироксина в крови примерно в 20 раз больше, чем трийодтиронина. Тироксин при дейодировании может превращаться в трийодтиронин. На основании этих фактов предполагают, что основным гормоном щитовидной железы является трийодтиронин, а тироксин выполняет функцию его предшественника.
Действие гормонов щитовидной железы проявляется резким усилением метаболической активности организма. При этом ускоряются все виды обмена веществ (белковый, липидный, углеводный), что приводит к увеличению энергообразования и повышению основного обмена. В детском возрасте это имеет существенное значение для процессов роста, физического развития, а также энергетического обеспечения созревания ткани мозга, поэтому недостаток гормонов щитовидной железы у детей приводит к задержке умственного и физического развития (кретинизм). У взрослых при гипофункции щитовидной железы наблюдается торможение нервно-психической активности (вялость, сонливость, апатия); при избытке гормонов, наоборот, наблюдаются эмоциональная лабильность, возбуждение, бессонница.
В результате активизации всех видов обмена веществ под влиянием гормонов щитовидной железы изменяется деятельность практически всех органов. Усиливается теплопродукция, что приводит к повышению температуры тела. Ускоряется работа сердца (тахикардия, повышение АД, увеличение минутного объема крови), стимулируется деятельность пищеварительного тракта (повышение аппетита, усиление перистальтики кишечника, увеличение секреторной активности). При гиперфункции щитовидной железы обычно снижается масса тела. Недостаток гормонов щитовидной железы приводит к изменениям обратного характера.
Кальцитонин, или тиреокальцитонин, снижает уровень кальция в крови. Он действует на костную систему, почки и кишечник, вызывая при этом эффекты, противоположные действию паратирина. В костной ткани тиреокальцитонин усиливает активность остеобластов и процессы минерализации. В почках и кишечнике угнетает реабсорбцию кальция и стимулирует обратное всасывание фосфатов. Реализация этих эффектов приводит к гипокальциемии.
Секреция гормонов щитовидной железы регулируется гипоталамическим тиреолиберином. Выработка тироксина и трийодтиронина резко усиливается в условиях длительного эмоционального возбуждения. Отмечено также, что секреция этих гормонов ускоряется при снижении температуры тела.
Регуляция обмена кальция осуществляется в основном за счет действия паратирина и кальцитонина.Паратгормон, или паратирин, паратиреоидный гормон, синтезируется в околощитовидных железах. Он обеспечивает увеличение уровня кальция в крови. Органами-мишенями для этого гормона являются кости и почки. В костной ткани паратирин усиливает функцию остеокластов, что способствует деминерализации кости и повышению уровня кальция и фосфора в плазме крови. В канальцевом аппарате почек паратирин стимулирует реабсорбцию кальция и тормозит реабсорбцию фосфатов, что приводит к гиперкальциемии и фосфатурии. Развитие фосфатурии может иметь определенное значение в реализации гиперкальциемического эффекта гормона. Это связано с тем, что кальций образует с фосфатами нерастворимые соединения; следовательно, усиленное выведение фосфатов с мочой способствует повышению уровня свободного кальция в плазме крови. Паратирин усиливает синтез кальцитриола, который является активным метаболитом витамина D3. Последний вначале образуется в неактивном состоянии в коже под влиянием ультрафиолетового излучения, а затем под влиянием паратирина происходит его активация в печени и почках. Кальцитриол усиливает образование кальцийсвязывающего белка в стенке кишечника, что способствует обратному всасыванию кальция и развитию гиперкальциемии. Таким образом, увеличение реабсорбции кальция в кишечнике при гиперпродукции паратирина в основном обусловлено его стимулирующим действием на процессы активации витамина D3. Прямое влияние самого паратирина на кишечную стенку весьма незначительно.
При удалении околощитовидных желез животное погибает от тетанических судорог. Это связано с тем, что в случае низкого содержания кальция в крови резко усиливается нервно-мышечная возбудимость. При этом действие даже незначительных по силе внешних раздражителей приводит к сокращению мышц.
Гиперпродукция паратирина приводит к деминерализации и резорбции костной ткани, развитию остеопороза. Резко увеличивается уровень кальция в плазме крови, в результате чего усиливается склонность к камнеобразованию в органах мочеполовой системы. Гиперкальциемия способствует развитию выраженных нарушений электрической стабильности сердца, а также образованию язв в пищеварительном тракте, возникновение которых обусловлено стимулирующим действием ионов Са2+ на выработку гастрина и соляной кислоты в желудке.
Секреция паратирина и тиреокальцитонина (см. раздел 5.2.3) регулируется по типу отрицательной обратной связи в зависимости от уровня кальция в плазме крови. При снижении содержания кальция усиливается секреция паратирина и тормозится выработка тиреокальцитонина. В физиологических условиях это может наблюдаться при беременности, лактации, сниженном содержании кальция в принимаемой пище. Увеличение концентрации кальция в плазме крови, наоборот, способствует снижению секреции паратирина и увеличению выработки тиреокальцитонина. Последнее может иметь большое значение у детей и лиц молодого возраста, так как в этом возрасте осуществляется формирование костного скелета. Адекватное протекание этих процессов невозможно без тиреокальцитонина, определяющего абсорбцию кальция из плазмы крови и его включение в структуру костной ткани.
В надпочечниках выделяют корковое и мозговое вещество. Корковое вещество включает клубочковую, пучковую и сетчатую зоны. В клубочковой зоне происходит синтез минералокортикоидов, основным представителем которых является альдостерон. В пучковой зоне синтезируются глюкокортикоиды. В сетчатой зоне вырабатывается небольшое количество половых гормонов.
Альдостерон усиливает в дистальных канальцах почек реабсорбцию ионов Na+, одновременно увеличивая при этом выведение-с мочой ионов К+. Аналогичное усиление натрий-калиевого обмена происходит в потовых слюнных железах, а также в кишечнике. Это приводит к изменению электролитного состава плазмы крови (гипернатриемия и гипокалиемия). Кроме того, под влиянием альдостерона резко возрастает почечная реабсорбция воды, которая всасывается пассивно по осмотическому градиенту, создаваемому ионами Na+. Это приводит к существенным изменениям гемодинамики — увеличивается объем циркулирующей крови, возрастает АД. Вследствие усиленного обратного всасывания воды уменьшается диурез. При повышенной секреции альдостерона увеличивается склонность к отекам, что обусловлено задержкой в организме натрия и воды, повышением гидростатического давления крови в капиллярах и в связи с этим — усиленной экссудацией жидкости из просвета сосудов в ткани. За счет усиления процессов экссудации и отечности тканей альдостерон способствует развитию воспалительной реакции и является провоспалительным гормоном. Под влиянием альдостерона увеличивается также секреция ионов Н+ в канальцевом аппарате почек, что приводит к снижению их концентрации во внеклеточной жидкости и изменению кислотно-основного состояния (алкалоз).
Снижение секреции альдостерона вызывает усиленное выведение натрия и воды с мочой, что приводит к дегидратации тканей, снижению объема циркулирующей крови и уровня АД. В результате в организме возникают явления циркуляторного шока. Концентрация калия в крови при этом, наоборот, увеличивается, что является причиной нарушения электрической стабильности сердца и развития сердечных аритмий.
Основным фактором, регулирующим секрецию альдостерона, является функционирование ренин-ангиотензин-альдостероновой системы. При снижении уровня АД наблюдается возбуждение симпатической части автономной нервной системы, что приводит к сужению почечных сосудов. Уменьшение почечного кровотока способствует усиленной выработке ренина в юкстагломерулярных нефронах почек. Ренин является ферментом, который действует на плазменный α2-глобулин ангиотензиноген, превращая его в ангиотензин I. Образовавшийся ангиотензин I затем превращается в ангиотензин II, который увеличивает секрецию альдостерона. Выработка альдостерона может усиливаться также по механизму обратной связи при изменении электролитного состава плазмы крови, в частности при гипонатриемии или гиперкалиемии. В незначительной степени секреция этого гормона стимулируется кортикотропином.
Глюкокортикоиды вызывают следующие эффекты:
1. Влияют на все виды обмена веществ:
а) на белковый обмен. Под влиянием глюкокортикоидов стимулируются процессы распада белка. В основе этого эффекта лежит угнетение транспорта аминокислот из плазмы крови в клетки, что вызывает торможение последующих стадий белкового синтеза. Катаболизм белка приводит к снижению мышечной массы, остеопорозу; уменьшается также скорость заживления ран. Распад белка приводит к уменьшению содержания белковых компонентов в защитном мукоидном слое, покрывающем слизистую оболочку пищеварительного тракта. Последнее способствует увеличению агрессивного действия соляной кислоты и пепсинах что может привести к образованию пептических язв (ульцерогенный эффект глюкокортикоидов);
б) на жировой обмен. Глюкокортикоиды усиливают мобилизацию жира из жировых депо и увеличивают концентрацию жирных кислот в плазме крови. Вместе с тем увеличивается отложение жира в области лица, груди и на боковых поверхностях туловища;
в) на углеводный обмен. Введение глюкокортикоидов приводит к увеличению содержания глюкозы в плазме крови (гипергликемия). В основе этого эффекта лежит стимулирующее действие на процессы глюконеогенеза. Избыток аминокислот, образовавшихся в результате катаболизма белка, используется для синтеза глюкозы в печени. Кроме того, глюкокортикоиды ингибируют активность фермента гексокиназы, что препятствует утилизации глюкозы тканями. Поскольку при избытке глюкокортикоидов основным источником энергии являются жирные кислоты, образующиеся за счет усиленной мобилизации жира, определенное количество глюкозы сберегается от энергетических трат, что также способствует гипергликемии. Гипергликемический эффект является одним из компонентов защитного действия глюкокортикоидов при стрессе, поскольку в виде глюкозы в организме создается запас энергетического субстрата, расщепление которого помогает преодолеть действие экстремальных стимулов.
Таким образом, по характеру своего влияния на углеводный обмен глюкокортикоиды являются антагонистами инсулина. При длительном приеме этих гормонов с целью лечения или повышенной их выработке в организме может развиться стероидный диабет.
2. Противовоспалительное действие. Глюкокортикоиды угнетают все стадии
воспалительной реакции (альтерацию, экссудацию и
пролиферацию), стабилизируют мембраны лизосом, что предотвращает выброс
протеолитических ферментов, способствующих развитию воспалительной реакции.
Глюкокортикоиды нормализуют повышенную проницаемость сосудов и тем самым
уменьшают процессы
экссудации и отечность тканей, а также выделение
медиаторов воспалительной реакции. Глюкокортикоиды угнетают процессы фагоцитоза
в очаге воспаления. Кроме того, они уменьшают выраженность лихорадочной реакции,
сопутствующей воспалительному процессу, за счет снижения выброса интерлейкина-1
из лейкоцитов, что снижает его стимулирующий эффект на центр теплопродукции в
гипоталамусе.
3. Противоаллергическое действие. Изложенные выше эффекты, лежащие в
основе противовоспалительного действия, во многом определяют также
ингибирующее действие глюкокортикоидов на развитие аллергической реакции
(стабилизации лизосом, угнетение
образования факторов, усиливающих
аллергическую реакцию, снижение экссудации и др.). Гиперпродукция
глюкокортикоидов приводит к снижению числа эозинофилов в крови, увеличенное
количество которых обычно является «маркером» аллергии.
4. Подавление иммунитета. Глюкокортикоиды угнетают как клеточный, так и гуморальный иммунитет, что связано со снижением образования антител и процессов фагоцитоза. Длительный прием глюкокортикоидов приводит к инволюции тимуса и лимфоидной ткани, являющихся иммунокомпетентными органами, вследствие чего уменьшается количество лимфоцитов в крови. Подавление иммунитета может являться серьезным побочным эффектом при длительном приеме глюкокортикоидов, поскольку при этом возрастает вероятность присоединения вторичной инфекции. С другой стороны, этот эффект может являться терапевтическим при использовании глюкокортикоидов для подавления роста опухолей, происходящих из лимфоидной ткани, или для торможения реакций отторжения при трансплантации органов и тканей.
5. Участие в формировании необходимого уровня АД. Глюкокортикоиды повышают чувствительность сосудистой стенки к действию катехоламинов, что приводит к гипертензии. Повышению уровня АД способствует также выраженное в небольшой степени минералокортикоидное действие глюкокортикоидов (задержка в организме натрия и воды, сопровождающаяся увеличением объема циркулирующей крови). Гипертензивный эффект является одним из компонентов противошокового действия (шок всегда сопровождается резким падением АД). Противошоковая активность этих гормонов связана также с гипергликемией. Поскольку утилизация глюкозы мозговой тканью не зависит от инсулина, поступление глюкозы в клетки мозга определяется исключительно ее концентрацией в плазме крови. В связи с этим вызванная глюкокортикоидами гипергликемия может расцениваться как важный фактор адекватного энергетического обеспечения мозга, что противодействует развитию шока.
В организме существует определенный суточный ритм выработки глюкокортикоидов. Основная масса этих гормонов вырабатывается в утренние часы (6—8 ч утра). Последнее учитывают при распределении суточной дозы гормонов в процессе длительного лечения глюкокортикоидами.
Продукция глюкокортикоидов регулируется кортикотропином. Его выделение усиливается при действии на организм стрессорных стимулов различной природы, что является пусковым моментом для развития адаптационного синдрома.
Половые гормоны. При избыточном образовании половых гормонов в сетчатой зоне развивается адреногенитальный синдром двух типов — гетеросексуальный и изосексуальный. Гетеросексуальный синдром развивается при выработке гормонов противоположного пола и сопровождается появлением вторичных половых признаков, присущих другому полу. Изосексуальный синдром наступает при избыточной выработке гормонов одноименного пола и проявляется ускорением процессов полового развития.
Катехоламины. В мозговом веществе надпочечников содержатся хромаффинные клетки, в которых синтезируются адреналин и норадреналин. Примерно 80% гормональной секреции приходится на адреналин и 20% — на норадреналин. Продукция этих гормонов резко усиливается при возбуждении симпатической части автономной нервной системы. В свою очередь выделение этих гормонов в кровь приводит к развитию эффектов, аналогичных действию стимуляции симпатических нервов. Разница состоит лишь в том, что гормональный эффект является более длительным. К наиболее важ-ным эффектам катехоламинов относятся стимуляция деятельности сердца, вазоконстрикция, торможение перистальтики и секреции кишечника, расширение зрачка, уменьшение потоотделения, усиление процессов катаболизма и образования энергии. Адреналин имеет большее сродство к β-адренорецепторам, локализующимся в миокарде, вследствие чего вызывает положительные инотропный и хронотропный эффекты в сердце. С другой стороны, норадреналин имеет более высокое сродство к сосудистым α-адренорецепторам. Поэтому, вызываемые катехоламинами вазоконстрикция и увеличение периферического сосудистого сопротивления в большей степени обусловлены действием норадреналина.
Эндокринная активность поджелудочной железы осуществляется панкреатическими островками (островками Лангерганса). В островковом аппарате представлено несколько типов клеток:
1) α-клетки, в которых происходит выработка глюкагона;
2) β-клетки, вырабатывающие инсулин;
3) δ-клетки, продуцирующие соматостатин, который угнетает секрецию инсулина и глюкагона;
4) G-клетки, вырабатывающие гастрин;
5) ПП-клетки, вырабатывающие небольшое количество панкреатического полипептида, который является антагонистом холецистокинина.
β-Клетки составляют большую часть островкового аппарата поджелудочной железы (примерно 60%). Они продуцируют инсулин, который влияет на все виды обмена веществ, но, прежде всего, снижает уровень глюкозы в плазме крови.
Под воздействием инсулина существенно увеличивается проницаемость клеточной мембраны для глюкозы и аминокислот, что приводит к усилению биоэнергетических процессов и синтеза белка. Кроме того, в результате подавления активности ферментов, обеспечивающих глюконеогенез, тормозится образование глюкозы из аминокислот, поэтому они могут быть использованы для биосинтеза белка. Под влиянием инсулина уменьшается катаболизм белка. Таким образом, процессы образования белка начинают преобладать над процессами его распада, что обеспечивает анаболический эффект. По своему влиянию на белковый обмен инсулин является синергистом соматотропина. Более того, установлено, что адекватная стимуляция роста и физического развития под влиянием соматотропина может происходить только при условии достаточной концентрации инсулина в крови.
Влияние инсулина на жировой обмен, в конечном счете, выражается в усилении процессов липогенеза и отложении жира в жировых депо. Поскольку под влиянием инсулина возрастает утилизация тканями и использование глюкозы в качестве энергетического субстрата, определенная часть жирных кислот сберегается от энергетических трат и используется в последующем для липогенеза. Кроме того, дополнительное количество жирных кислот образуется из глюкозы, а также за счет ускорения их синтеза в печени. В жировых депо инсулин угнетает активность липазы и стимулирует образование триглицеридов.
Недостаточная секреция инсулина приводит к развитию сахарного диабета. При этом резко увеличивается содержание глюкозы в плазме крови, возрастает осмотическое давление внеклеточной жидкости, что приводит к дегидратации тканей, появлению жажды. Поскольку глюкоза относится к «пороговым» веществам, то при определенном уровне гипергликемии тормозится ее реабсорбция в почках и возникает глюкозурия. Вследствие того что глюкоза является осмотически активным соединением, в составе мочи возрастает также количество воды, что приводит к увеличению диуреза (полиурия). Усиливается липолиз с образованием избыточного количества несвязанных жирных кислот; происходит образование кетоновых тел. Катаболизм белка и недостаток энергии (нарушена утилизация глюкозы) приводит к астении и снижению массы тела.
Избыточное содержание инсулина в крови вызывает резкую гипогликемию, что может привести к потере сознания (гипогликемическая кома). Это объясняется тем, что в головном мозге утилизация глюкозы не зависит от действия фермента гексокиназы, активность которой регулируется инсулином. В связи с этим поглощение глюкозы мозговой тканью определяется в основном концентрацией глюкозы в плазме крови. Ее снижение под действием инсулина может привести к нарушению энергетического обеспечения мозга и потере сознания.
Выработка инсулина регулируется механизмом отрицательной обратной связи в зависимости от концентрации глюкозы в плазме крови. Повышение содержания глюкозы способствует увеличению выработки инсулина; в условиях гипогликемии образование инсулина, наоборот, тормозится. Секреция инсулина в некоторой степени возрастает при росте содержания аминокислот в крови. Увеличение выхода инсулина наблюдается также под действием некоторых гастроинтестинальных гормонов (желудочный ингибирующий пептид, холецистокинин, секретин). Кроме того, продукция инсулина может возрастать при стимуляции блуждающего нерва. В опытах на животных показано, что при пропускании крови с высоким содержанием глюкозы через сосуды головы, которая соединена с телом только блуждающими нервами, наблюдается увеличение продукции инсулина.
α-Клетки, составляющие примерно 25% островковой ткани, вырабатывают глюкагон, действие которого приводит к гипергликемии. В основе этого эффекта лежат усиленный распад гликогена в печени и стимуляция процессов глюконеогенеза. Глюкагон способствует мобилизации жира из жировых депо. Таким образом, действие глюкагона противоположно эффектам инсулина. Установлено, что, кроме глюкагона, существует еще несколько гормонов, которые по своему действию на углеводный обмен являются антагонистами инсулина. Введение этих гормонов приводит к гипергликемии. К ним относятся кортикотропин, соматотропин, глюкокортикоиды, адреналин, тироксин.
Мужские половые железы. В мужских половых железах (яички) происходят процессы сперматогенеза и образование мужских половых гормонов — андрогенов. Сперматогенез осуществляется за счет деятельности сперматогенных эпителиальных клеток, которые содержатся в семенных канальцах. Выработка андрогенов происходит в интерстициальных клетках — гландулоцитах (клетки Лейдига), локализующихся в интерстиции между семенными канальцами и составляющих примерно 20% от общей массы яичек. Небольшое количество мужских половых гормонов вырабатывается также в сетчатой зоне коркового вещества надпочечников. К андрогенам относится несколько стероидных гормонов, наиболее важным из которых является тестостерон. Продукция этого гормона определяет адекватное развитие мужских первичных и вторичных половых признаков (маскулинизирующий эффект). Под влиянием тестостерона в период полового созревания увеличиваются размеры полового члена и яичек, появляется мужской тип оволосения, меняется тональность голоса. Кроме того, тестостерон усиливает синтез белка (анаболический эффект), что приводит к ускорению процессов роста, физического развития, увеличению мышечной массы. Тестостерон влияет на процессы формирования костного скелета — он ускоряет образование белковой матрицы кости, усиливает отложение в ней солей кальция. В результате увеличиваются рост, толщина и прочность кости. При гиперпродукции тестостерона ускоряется обмен веществ, в крови возрастает количество эритроцитов.
Механизм действия тестостерона обусловлен его проникновением внутрь клетки, превращением в более активную форму (дигидротестостерон) и дальнейшим связыванием с рецепторами ядра и органелл, что приводит к изменению процессов синтеза белка и нуклеиновых кислот. Секреция тестостерона регулируется лютеинизирующим гормоном аденогипофиза, продукция которого возрастает в период полового созревания. При увеличении содержания в крови тестостерона по механизму отрицательной обратной связи тормозится выработка лютеинизирующего гормона. Уменьшение продукции обоих гонадотропных гормонов — фолликулостимулирующего и лютеинизирующего, происходит также при ускорении процессов сперматогенеза.
У мальчиков в возрасте до 10—11 лет в яичках обычно отсутствуют активные гландулоциты (клетки Лейдига), в которых вырабатываются андрогены. Однако секреция тестостерона в этих клетках происходит во время внутриутробного развития и сохраняется у ребенка в течение первых недель жизни. Это связано со стимулирующим действием хорионического гонадотропина, который продуцируется плацентой.
Недостаточная секреция мужских половых гормонов приводит к развитию евнухоидизма, основными проявлениями которого являются задержка развития первичных и вторичных половых признаков, диспропорциональность костного скелета (несоразмерно длинные конечности при относительно небольших размерах туловища), увеличение отложения жира на груди, в нижней части живота и на бедрах. Нередко отмечается увеличение молочных желез (гинекомастия). Недостаток мужских половых гормонов приводит также к определенным нервно-психическим изменениям, в частности к отсутствию влечения к противоположному полу и утрате других типичных психофизиологических черт мужчины.
Женские половые железы. В женских половых железах (яичники) происходит выработка эстрогенов и прогестерона. Секреция этих гормонов характеризуется определенной цикличностью, связанной с изменением продукции гипофизарных гонадотропинов в течение менструального цикла. Эстрогены, помимо яичников, в небольшом количестве могут также вырабатываться в сетчатой зоне коркового вещества надпочечников. Во время беременности секреция эстрогенов существенно увеличивается за счет гормональной активности плаценты. Наиболее активным представителем этой группы гормонов является β-эстрадиол. Прогестерон представляет собой гормон желтого тела; его продукция возрастает в конце менструального цикла.
Под влиянием эстрогенов ускоряется развитие первичных и вторичных женских половых признаков. В период полового созревания увеличиваются размеры яичников, матки, влагалища, а также наружных половых органов. Усиливаются процессы пролиферации и рост желез в эндометрии. Эстрогены ускоряют развитие молочных желез, что приводит к увеличению их размеров, ускоренному формированию протоковой системы. Эстрогены влияют на развитие костного скелета посредством усиления активности остеобластов. Вместе с тем за счет влияния на эпифизарный хрящ тормозится рост костей в длину. Действие этих гормонов приводит к увеличению биосинтеза белка; усиливается также образование жира, избыток которого откладывается в подкожной основе, что определяет внешние особенности женской фигуры. Под влиянием эстрогенов развивается оволосение по женскому типу: кожа становится более тонкой и гладкой, а также хорошо васкуляризованной.
Основное назначение прогестерона заключается в подготовке эндометрия к имплантации оплодотворенной яйцеклетки. Под действием этого гормона усиливается пролиферация и секреторная активность клеток эндометрия, в цитоплазме накапливаются липиды и гликоген, усиливается васкуляризация. Усиление пролиферации и секреторной активности происходит также в молочных железах, что приводит к увеличению их размера.
Недостаточная секреция женских половых гормонов влечет за собой развитие характерного симптомокомплекса, основными признаками которого являются прекращение менструаций, атрофия молочных желез, влагалища и матки, отсутствие характерного оволосения по женскому типу. Существенные изменения претерпевает костная система — задерживается окостенение зоны эпифизарного хряща, что стимулирует рост кости в длину. Как правило, это больные высокого роста, с несоразмерно удлиненными конечностями, суженным и уплощенным тазом. Внешний вид приобретает мужские черты, тембр голоса становится низким.
Выработка эстрогенов и прогестерона регулируется гипофизарными гонадотропинами, продукция которых возрастает у девочек, начиная с возраста 9—10 лет. Секреция гонадотропинов тормозится при высоком содержании в крови женских половых гормонов.
5.3. ОБРАЗОВАНИЕ, СЕКРЕЦИЯ И МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
5.3.1. Регуляция биосинтеза гормонов
В поддержании упорядоченности, согласованности всех физиологических и метаболических процессов в организме участвует более 100 гормонов и нейромедиаторов. Их химическая природа различна (белки, полипептиды, пептиды, аминокислоты и их производные, стероиды, производные жирных кислот, некоторые нуклеотиды, эфиры и т. д.). У каждого класса этих веществ пути образования и распада разные.
Белково-пептидные гормоны. В эту группу входят все тропные гормоны, либерины и статины, инсулин, глюкагон, кальцитонин, гастрин, секретин, холецистокинин, ангиотензин II, антидиуретический гормон (вазопрессин), паратиреоидный гормон и др.
Эти гормоны образуются из белковых предшественников, называемых прогормонами. Как правило, сначала синтезируется препрогормон, из которого образуется прогормон, а затем гормон.
Синтез прогормонов осуществляется на мембранах гранулярной эндоплазматической сети (шероховатый ретикулум) эндокринной клетки (рис 5.4). Большое значение для этих процессов имеет способность препрогормонов проникать через мембрану эндоплазматической сети в ее внутренние полости за счет того, что первые 20—25 аминокислотных остатков с N-конца у многих белковых предшественников являются одинаковыми, а на наружной мембране эндоплазматической сети имеются структуры, «узнающие» эту последовательность. В результате становится возможным внедрение молекулы препрогормона в липидный бислой мембраны и постепенное проникновение белкового предшественника во внутреннее пространство эндоплазматической сети.
Везикулы с образующимся прогормоном переносятся затем в пластинчатый комплекс (комплекс Гольджи), где под действием мембранной протеиназы от молекулы прогормона отщепляется определенная часть аминокислотной цепи. В результате образуется гормон, который поступает в везикулы, содержащиеся в комплексе Гольджи. В дальнейшем эти везикулы сливаются с плазматической мембраной и высвобождаются во внеклеточное пространство.
|
|
|
Рис. 5.4. Синтез, внутриклеточный транспорт и секреция белково-пептидных гормонов. |
Различные этапы синтеза гормонов имеют неодинаковую продолжительность. Например, синтез молекулы проинсулина происходит за 1—2 мин. Транспорт проинсулина от эндоплазматической сети до комплекса Гольджи занимает 10—20 мин. «Созревание» везикул, несущих инсулин от комплекса Гольджи до плазматической мембраны, длится 1—2 ч. При действии глюкозы на β-клетки панкреатических островков (см. рис. 5.1) стимулируется главным образом слияние инсулиновых везикул с плазматическими мембранами, что и приводит к усиленной секреции инсулина, а скорость предыдущих этапов образования гормонов изменяется в меньшей степени. Концентрация других пептидных гормонов в крови также регулируется не влиянием на скорость их синтеза или внутриклеточного транспорта, а изменением скорости секреции. Во многом это обусловлено тем, что в секреторных гранулах содержится такое количество гормона, что его концентрация в крови может многократно повышаться без дополнительного синтеза.
Поскольку многие полипептидные гормоны образуются из общего белкового предшественника, изменение синтеза одного из этих гормонов может приводить к параллельному изменению (ускорению или замедлению) синтеза ряда других гормонов. Так, из белка проопиокортина образуются кортикотропин и β-липотропин (схема 5.1), из β-липотропина может образоваться еще несколько гормонов: γ-липотропин, β-меланоцитостимулирующий гормон, β-эндорфин, γ-эндорфин, α-эндорфин, метионин-энкефалин.
При действии специфических протеиназ из кортикотропина могут образовываться α-меланоцитостимулирующий гормон и АКТГ-подобный пептид средней доли гипофиза. Благодаря сходству структур кортикотропина и α-меланоцитостимулирующего гормона последний имеет слабую кортикотропную активность. Кортикотропин обладает незначительной способностью усиливать пигментацию кожи.
|
|
|
Схема 5.1. Образование нескольких белково-пептидных гормонов из одного белкового предшественника под действием стресса |
Концентрация белково-пептидных гормонов в крови обычно составляет 10-9—10-10 М. При стимуляции эндокринной железы концентрация соответствующего гормона возрастает в 2—5 раз.
Период полураспада белково-пептидных гормонов в крови составляет 10—20 мин. Они разрушаются протеиназами клеток-мишеней, крови, печени и почек.
Стероидные гормоны. В эту группу входят тестостерон, эстрадиол, эстрон, прогестерон, кортизол, альдостерон и др. Эти гормоны образуются из холестерина в корковом веществе надпочечников (кортикостероиды), а также в семенниках и яичниках (половые стероиды). В малом количестве половые стероиды могут образовываться в корковом веществе надпочечников, а кортикостероиды — в половых железах. Свободный холестерин поступает в митохондрии, где превращается в прегненолон, который затем попадает в эндоплазматическую сеть и после этого — в цитоплазму.
В корковом веществе надпочечников синтез стероидных гормонов стимулируется кортикотропином, а в половых железах — лютеинизирующим гормоном (ЛГ). Эти гормоны ускоряют транспорт эфиров холестерина в эндокринные клетки и активируют митохондриальные ферменты, участвующие в образовании прегненолона. Кроме того, тропные гормоны активируют процессы окисления сахаров и жирных кислот в эндокринных клетках, что обеспечивает стероидогенез энергией и пластическим материалом.
Кортикостероиды. Подразделяют на две группы. Глюкокортикоиды (типичный представитель — кортизол) индуцируют синтез ферментов глюконеогенеза в печени, препятствуют поглощению глюкозы мышцами и жировыми клетками, а также способствуют высвобождению из мышц молочной кислоты и аминокислот, тем самым ускоряя глюконеогенез в печени.
Минералокортикоиды (типичный представитель — альдостерон) задерживают натрий в крови. Снижение концентрации натрия (см. раздел 5.2.5) в выделяемой моче, а также секретах слюнных и потовых желез приводит к меньшим потерям воды, так как вода движется через биологические мембраны в направлении высокой концентрации солей.
Стимуляция синтеза глюкокортикоидов осуществляется через систему гипоталамус—гипофиз—надпочечники (см. рис. 5.2). Стресс (эмоциональное возбуждение, боль, холод и т. п.), тироксин, адреналин и инсулин стимулируют секрецию кортиколиберина из аксонов гипоталамуса. Этот гормон связывается с мембранными рецепторами аденогипофиза и вызывает секрецию кортикотропина, который с током крови попадает в надпочечники и стимулирует там образование глюкокортикоидов — гормонов, повышающих устойчивость организма к неблагоприятным воздействиям.
Кортикотропин влияет слабо на синтез минералокортикоидов. Имеется дополнительный механизм регуляции синтеза минералокортикоидов, осуществляющийся через так называемую ренин-ангиотензиновую систему. Рецепторы, реагирующие на давление крови, локализованы в артериолах почек. При снижении давления крови эти рецепторы стимулируют секрецию ренина почками. Ренин является специфической эндопептидной, отщепляющей от α2-глобулина крови С-концевой декапептид, который называют «ангиотензин I». От ангиотензина I карбоксипептидаза (ангиотензинпревращающий фермент, расположенный на наружной поверхности эндотелия кровеносных сосудов) отщепляет два аминокислотных остатка и образует октапептид ангиотензин II — гормон, к которому на мембране клеток коркового вещества надпочечников имеются специальные рецепторы. Связываясь с этими рецепторами, ангиотензин II стимулирует образование альдостерона, который действует на дистальные канальцы почек, потовые железы, слизистую оболочку кишечника и увеличивает в них реабсорбцию ионов Na+, Сl- и НСОз-. В результате в крови повышается концентрация ионов Na+ и снижается концентрация ионов Сl- и К+. Эти эффекты альдостерона полностью блокируются ингибиторами синтеза белка.
Половые стероиды. Андрогены (мужские половые гормоны) продуцируются интерстициальными клетками (гландулоцитами) семенников и в меньшем количестве яичниками и корковым веществом надпочечников. Основным андрогеном является тестостерон (см. раздел 5.2.7). Этот гормон может претерпевать изменения в клетке-мишени — превращаться в дигидротестостерон, который обладает большей активностью, чем тестостерон. Следует отметить, что ЛГ, который стимулирует начальные этапы биосинтеза стероидов в эндокринной железе, активирует также превращение тестостерона в дигидротестостерон в клетке-мишени, тем самым, усиливая андрогенные эффекты.
Эстрогены (женские половые гормоны) в организме человека в основном представлены эстрадиолом. В клетках-мишенях они не метаболизируются.
Действие андрогенов и эстрогенов направлено в основном на органы воспроизведения, проявление вторичных половых признаков, поведенческие реакции. Андрогенам свойственны также анаболические эффекты — усиление синтеза белка в мышцах, печени, почках. Эстрогены оказывают катаболическое влияние на скелетные мышцы, но стимулируют синтез белка в сердце и печени. Таким образом, основные эффекты половых гормонов опосредуются процессами индукции и репрессии синтеза белка.
Стероидные гормоны легко проникают через клеточную мембрану, поэтому их секреция происходит параллельно с синтезом. Содержание стероидов в крови определяется соотношением скоростей их синтеза и распада. Регуляция этого содержания осуществляется главным образом путем изменения скорости синтеза. Тропные гормоны (кортикотропин, ЛГ и ангиотензин) стимулируют этот синтез. Устранение тропного влияния приводит к торможению синтеза стероидных гормонов.
Действующие концентрации стероидных гормонов составляют 10-11—10-9 М. Период их полураспада равен 1/2—11/2 ч.
Тиреоидные гормоны. В эту группу входят тироксин и трийодтиронин. Синтез этих гормонов осуществляется в щитовидной железе, в которой ионы йода окисляются при участии пероксидазы до йодиниум-иона, способного йодировать тиреоглобулин — тетрамерный белок, содержащий около 120 тирозинов. Йодирование тирозиновых остатков происходит при участии пероксида водорода и завершается образованием монойодтирозинов и дийодтирозинов. После этого происходит «сшивка» двух йодированных тирозинов. Эта окислительная реакция протекает с участием пероксидазы и завершается образованием в составе тиреоглобулина трийодтиронина и тироксина. Для того чтобы эти гормоны освободились из связи с белком, должен произойти протеолиз тиреоглобулина. При расщеплении одной молекулы этого белка образуется 2—5 молекул тироксина (Т4) и трийодтиронина (Тз), которые секретируются в молярных соотношениях, равных 4:1.
Синтез и секреция тиреоидных гормонов находятся под контролем гипоталамо-гипофизарной системы. Тиреотропин активирует аденилатциклазу щитовидной железы, ускоряет активный транспорт йода, а также стимулирует рост эпителиальных клеток щитовидной железы. Эти клетки формируют фолликул, в полости которого происходит йодирование тирозина.
Выделение Тз и Т4 осуществляется с помощью пиноцитоза. Частички коллоида окружаются мембраной эпителиальной клетки и поступают в цитоплазму в виде пиноцитозных пузырьков. При слиянии этих пузырьков с лизосомами эпителиальной клетки происходит расщепление тиреоглобулина, который составляет основную массу коллоида, что приводит к выделению Т3 и Т4. Тиреотропин и другие факторы, повышающие концентрацию цАМФ в щитовидной железе, стимулируют пиноцитоз коллоида, процесс образования и движения секреторных пузырьков. Таким образом, тиреотропин ускоряет не только биосинтез, но и секрецию Т3 и Т4. При повышении уровня Т3 и Т4 в крови подавляется секреция тиреолиберина и тиреотропина.
Тиреоидные гормоны могут циркулировать в крови в неизменном виде в течение нескольких дней. Такая устойчивость гормонов объясняется, по-видимому, образованием прочной связи с Т4-свя-зывающими глобулинами и преальбуминами в плазме крови. Эти белки имеют в 10—100 раз большее сродство к Т4, чем к T3, поэтому в крови человека содержится 300—500 мкг Т4 и лишь 6—12 мкг Т3.
Катехоламины. В эту группу входят адреналин, норадреналин и дофамин. Источником катехоламинов, как и тиреоидных гормонов, служит тирозин, однако при синтезе катехоламинов метаболизму подвергается свободная аминокислота. Синтез катехоламинов происходит в аксонах нервных клеток, запасание — в синаптических пузырьках. Катехоламины, образующиеся в мозговом веществе надпочечников, выделяются в кровь, а не в синаптическую щель, т. е. являются типичными гормонами.
В некоторых клетках синтез катехоламинов заканчивается образованием дофамина, а адреналин и норадреналин образуются в меньшем количестве. Такие клетки есть в составе гипоталамуса. Предполагают, что пролактостатином, т. е. гормоном гипоталамуса, подавляющим секрецию пролактина, является дофамин. Известны и другие структуры мозга (например, стриарная система), которые находятся под влиянием дофамина и нечувствительны, например, к адреналину.
В симпатических нервных волокнах дофамин не накапливается, а быстро превращается в норадреналин, который хранится в синаптических пузырьках. Адреналина в этих волокнах значительно меньше, чем норадреналина. В мозговом слое надпочечников биосинтез завершается образованием адреналина, поэтому норадреналина образуется в 4—6 раз меньше, а дофамина сохраняются лишь следы.
Синтез катехоламинов в мозговом веществе надпочечников стимулируется нервными импульсами, поступающими по чревному симпатическому нерву. Выделяющийся в синапсах ацетилхолин взаимодействует с холинергическими рецепторами никотинового типа и возбуждает нейросекреторную клетку надпочечника. Благодаря существованию нервно-рефлекторных связей надпочечники отвечают усилением синтеза и выделения катехоламинов в ответ на болевые и эмоциональные раздражители, гипоксию, мышечную нагрузку, охлаждение и т. д. Существуют и гуморальные пути регуляции активности клеток мозгового вещества надпочечников: синтез и выделение катехоламинов могут возрастать под действием инсулина, глюкокортикоидов, при гипогликемии.
Катехоламины подавляют как собственный синтез, так и выделение. В адренергических синапсах на пресинаптической мембране есть α-адренергические рецепторы. При выбросе катехоламинов в синапс эти рецепторы активируются и начинают оказывать ингибирующее влияние на секрецию катехоламинов. Аутоингибирование секреции обнаружено практически во всех тканях, секретирующих эти гормоны или нейромедиаторы.
В отличие от холинергических синапсов, постсинаптическая мембрана которых содержит как рецепторы, так и ацетилхолинэстеразу, разрушающую медиатор, удаление катехоламинов из синапса происходит в результате обратного захвата медиатора нервными окончаниями. Поступающие в нервное окончание из синапса катехоламины вновь концентрируются в специальных гранулах и могут повторно участвовать в синаптической передаче.
Определенное количество катехоламинов может диффундировать из синапсов в межклеточное пространство, а затем в кровь, поэтому содержание норадреналина в крови больше, чем адреналина, несмотря на то что мозговое вещество надпочечников секретирует в кровь адреналин, а норадреналин секретируется преимущественно в синапсах. При стрессе содержание катехоламинов повышается в 4—8 раз. Период полураспада катехоламинов в крови равен 1—3 мин.
Катехоламины могут инактивироваться в тканях-мишенях, печени и почках. Решающее значение в этом процессе играют два фермента — моноаминоксидаза, расположенная на внутренней мембране митохондрий, и катехол-О-метилтрансфераза, цитозольный фермент.
Эйкозаноиды. В эту группу входят простагландины, тромбоксаны и лейкотриены. Эйкозаноиды называют гормоноподобными веществами, так как они могут оказывать только местное действие, сохраняясь в крови в течение нескольких секунд. Образуются во всех органах и тканях практически всеми типами клеток.
Биосинтез большинства эйкозаноидов начинается с отщепления арахидоновой кислоты от мембранного фосфолипида или диацил-глицерина в плазматической мембране. Синтетазный комплекс представляет собой полиферментную систему, функционирующую преимущественно на мембранах эндоплазматической сети. Образующиеся эйкозаноиды легко проникают через плазматическую мембрану клетки, а затем через межклеточное пространство переносятся на соседние клетки или выходят в кровь и лимфу. Скорость синтеза эйкозаноидов увеличивается под влиянием гормонов и нейромедиаторов, активирующих аденилатциклазу или повышающих концентрацию ионов Са2+ в клетке. Наиболее интенсивно образование простагландинов происходит в семенниках и яичниках.
Простагландины могут активировать аденилатциклазу, тромбоксаны увеличивают активность фосфоинозитидного обмена, а лейкотриены повышают проницаемость мембран для ионов Са2+. Поскольку цАМФ и ионы Са2+ стимулируют синтез эйкозаноидов, замыкается положительная обратная связь в синтезе этих специфических регуляторов.
Во многих тканях кортизол тормозит освобождение арахидоновой кислоты, что приводит к подавлению образования эйкозаноидов, и тем самым оказывает противовоспалительное действие. Простагландин E1 является мощным пирогеном. Подавлением синтеза этого простагландина объясняют терапевтическое действие аспирина.
Период полураспада эйкозаноидов составляет 1—20 с. Ферменты, инактивирующие их, имеются практически во всех тканях, но наибольшее их количество содержится в легких.
5.3.2. Секреция и перенос гормонов
Гормоны, имеющие гидрофильную природу (катехоламины, серотонин, белково-пептидные и др.), синтезируются «впрок» и выделяются в кровь определенными порциями за счет опустошения секреторных везикул. Уровень этих гормонов в крови возрастает при увеличении частоты выброса гормона из клеток эндокринной железы. В отличие от этого стероидные и тиреоидине гормоны, а также эйкозаноиды не накапливаются в специальных структурах клетки, а благодаря своей липофильности свободно проходят через плазматическую мембрану эндокринной клетки и попадают в кровь. Содержание этих гормонов в крови регулируется ускорением или замедлением их синтеза.
Поступая в кровь, гормоны связываются с белками плазмы. Обычно лишь 5—10% молекул гормонов находится в крови в свободном состоянии, и только они могут взаимодействовать с рецепторами. К числу специфических гормонсвязывающих белков относятся транскортин, связывающий кортикостероиды, тестостерон-эстрогенсвязывающий глобулин, тироксинсвязывающий глобулин и т. д. Альдостерон, по-видимому, не имеет специфических «транспортных» белков, поэтому находится преимущественно в связи с альбумином.
Сравним механизмы выделения и переноса к клеткам-мишеням гормонов и нейромедиаторов. Нервное окончание подходит к одной клетке, и возбуждение передается только на эту клетку. Гормон активирует всю популяцию клеток, имеющих рецепторы этого гормона. Передача возбуждения с нерва на другую клетку осуществляется путем диффузии нейромедиатора к постсинаптической мембране, что завершается его связыванием с рецепторами иннервируемой клетки. Это самый медленный процесс в проведении нервного сигнала, однако, и он проходит очень быстро по сравнению с гормональной регуляцией, поскольку расстояние от места выделения до места рецепции нейромедиатора (ширина синаптической щели) составляет всего 20—30 нм. Гормон проходит путь от места выделения до места рецепции в миллион раз больший (десятки сантиметров). При этом выделившееся количество гормона разбавляется кровью и поэтому концентрация гормона составляет всего 10-11 — 10-1 М. Кроме того, гормональные рецепторы, которых в тканях содержится очень мало, чаще всего не сконцентрированы в определенном участке, а распределены в клетке равномерно. В отличие от этого концентрация нейромедиатора в синаптической щели достигает 10-4 —10-3 М, а рецепторы в постсинаптической мембране сконцентрированы на очень маленькой площади, причем точно напротив тех мест пресинаптической мембраны, из которых выбрасывается нейромедиатор. От момента секреции до связывания с рецептором у гормона проходят минуты или десятки минут, а у нейромедиатора — миллисекунды. Нейромедиаторы устраняются из постсинаптической щели или ферментами, сконцентрированными на постсинаптической мембране (ацетилхолин), или специальными механизмами «обратного захвата» нейромедиатора нервным окончанием (катехоламины). Этот процесс занимает несколько миллисекунд или секунд.
Гашение гормонального сигнала происходит медленно, так как гормоны растворены во всем объеме крови или лимфы и для понижения их концентрации необходимо «прогнать» большое количество крови через ткани-мишени, печень или почки, где происходит разрушение гормонов.
5.3.3. Механизмы действия гормонов на клетку
Влияние гормонов и нейромедиаторов на клетку осуществляется обычно по одному из трех путей: а) изменение распределения веществ в клетке; б) химическая модификация клеточных белков; в) индукция или репрессия процессов белкового синтеза. В последующем эти первичные эффекты приводят к изменению количества и активности регуляторных белков клетки, а также скорости ферментативных процессов, что вызывает физиологический ответ тканей на гормональный сигнал.
Одним из основных механизмов, лежащих в основе гормонального влияния на распределение (компартментализацию) веществ в клетке, является изменение ионной проницаемости клеточных мембран. Ионные каналы, работа которых регулируется нейромедиаторами, представляют собой олигомерные белковые комплексы, пронизывающие клеточную мембрану. Свойства этих олигомерных образований таковы, что молекула нейромедиатора, связываясь со специфическим участком на ионном канале, вызывает открывание или закрывание канала. Регуляторное влияние белково-пептидных гормонов, простагландинов, катехоламинов и др. опосредовано через систему вторичных посредников. В качестве последних могут выступать циклический АМФ (цАМФ), циклический ГМФ (цГМФ), инозитол-1,4,5-трифосфат, диацилглицерин или ионы Са2+. Диацилглицерин и инозитол-1,4,5-трифосфат образуются при активации фосфолипазы С, гидролизующей фосфоинозитиды. Образование этих посредников приводит к выходу ионов Са2+ из эндоплазматической сети и стимуляции протеинкиназы С.
На рис. 5.5 показан молекулярный механизм действия катехоламинов на клетку. Характер и степень выраженности эффекта гормона будут определяться соотношением в клетке числа активированных β-адренорецепторов, сопряженных с Gs-белком, α2-рецепторов, сопряженных с Gi-белком, и α1-рецепторов, сопряженных с Gq-белком. Gs- и Gi-белки могут соответственно активировать или ингибировать аденилатциклазу, синтезирующую цАМФ из АТФ. Gq-белок может активировать фосфолипазу С, которая из трифосфоинозитида (ТФИ) синтезирует диацилглицерин (ДАГ) и инозитолтрифосфат (ИФз). цАМФ активирует протеинкиназу, фосфорилирующую соответствующие субстраты. ИФз, имеющий фосфат в положениях 1, 4 и 5 инозитола, связывается с рецептором — каналоформером, расположенным на эндоплазматической сети, и вызывает выход ионов Са2+ в цитоплазму. Ион Са2+ взаимодействует с кальмодулином (КМ), в результате чего он присоединяется к кальцийзависимой протеинкиназе и тем самым активирует ее. ДАГ остается в мембране и присоединяется к протеинкиназе С, вызывая ее активацию.
|
|
|
Рис. 5.5. Механизм проведения гормонального сигнала в клетке при участии вторичных посредников. |
Разрушение или удаление из цитоплазмы клетки вторичных посредников блокирует гормональное влияние. В подавляющем большинстве случаев эти процессы также стимулируются гормонами. Через один и тот же биохимический механизм гормон может, как вызвать, так и погасить определенный биологический эффект.
В каждой клетке функционирует система, регулирующая чувствительность рецепторов к гормону. Проиллюстрируем ее на примере рецептора, сопряженного с G-белками, отметив, что основные закономерности этой регуляции присущи любому типу мембранного рецептора. Обычно уровень гормонов, действующих через активацию этих рецепторов, повышается на несколько минут. Этого времени достаточно, чтобы произошло образование нужного количества вторичных посредников (цАМФ, ионы Са2+, диацилглицерин и т. п.), которые вызовут активацию соответствующих протеинкиназ и последующее за этим фосфорилирование белков. Если же уровень гормона сохраняется повышенным в течение десятков минут или нескольких часов (из-за сверхмощного влияния внешних или внутренних сигналов на эндокринную железу, патологического состояния или фармакологического влияния), то развивается десенсибилизация соответствующего рецептора. Сначала протеинкиназа, которая есть в плазматической мембране практически всех клеток, фосфорилирует рецептор, в результате чего его сродство к гормону снижается в 2—5 раз. Фосфорилирование рецептора может происходить также под действием протеинкиназы, активированной вторичными посредниками. В результате этих реакций нарушается сопряжение рецепторов с G-белками. По этой причине связывание гормона с рецептором не приводит к активации внутриклеточных эффекторов (аденилатциклазы, фосфолипазы и др.). Если эти механизмы десенсибилизации не устраняют регуляторный сигнал, то происходит интернализация гормон-рецепторных комплексов, они переходят с поверхности внутрь клетки. При снижении концентрации гормона в крови эти рецепторы могут вновь встроиться в плазматическую мембрану. Если же этого не происходит, то интернализованные рецепторы разрушаются под действием лизосомальных ферментов. На определенных стадиях онтогенеза или при достижении критического отклонения от нормы того или иного фактора гомеостаза (гипотермия, гипогликемия, гипоксия, потеря крови и др.) включается медленная, но наиболее мощная система эндокринной регуляции, действующая через стероидные и тиреоидные гормоны. Молекулы этих регуляторов, будучи липофильными, легко проникают через липидный бислой и связываются со своими рецепторами в цитоплазме или ядре (рис. 5.6). Затем гормон-рецепторный комплекс связывается с ДНК и белками хроматина, что стимулирует транскрипцию определенных генов. Трансляция мРНК приводит к появлению в клетке новых белков, которые вызывают биологический эффект этих гормонов. Стероидные и тиреоидные гормоны могут также репрессировать некоторые гены, что реализуется в биологический эффект путем уменьшения количества соответствующих белков в клетке. Эффект действия этих гормонов на содержание того или иного белка в клетке реализуется не путем ускорения-замедления транскрипции функционирующих генов, а за счет включения-выключения новых генов.
|
|
|
Рис. 5.6. Механизм действия стероидных гормонов. Rq и Rb — две субъединицы рецепторов; Н — гормон. |